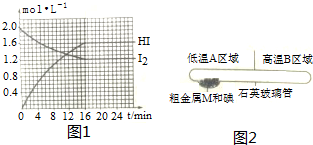
题目内容
11.关于反应Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O下列说法错误的是( )| A. | 每生成1mol单质硫,转移电子总数为2NA | |
| B. | 升高温度,生成硫沉淀的速率加快,说明升高温度可加快化学反应速率 | |
| C. | 增大压强对该反应的速率几乎没有影响 | |
| D. | 由于反应产生SO2气体,所以可以通过观察生成气泡的快慢比较稀、浓硫酸与Na2S2O3反应的速率大小 |
分析 A、反应Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O是歧化反应,Na2S2O3中S元素的化合价从+2价变为+4价和0价;
B、升温反应速率加快;
C、反应物中没有气体,压强对反应速率影响不大;
D、稀、浓硫酸与Na2S2O3反应的产物不同.
解答 解:A、Na2S2O3中S元素的化合价从+2价变为+4价和0价,每生成1molS,转移电子2mol,电子数为2NA,故A正确;
B、任何反应,升温反应速率都加快,故B正确;
C、反应物中没有气体,所以增大压强对该反应的速率几乎没有影响,故C正确;
D、浓硫酸会将+2价的S氧化为二氧化硫,本身还原为二氧化硫,因为反应不同,无法比较反应速率快慢,故D错误;
故选D.
点评 本题考查了氧化还原反应中元素化合价变化的分析、影响反应速率的因素,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1. 浓硫酸与少量铜片反应的实验,下列是对实验操作、实验现象或解释等的有关记录,其中与事实不符或解释不合理的是( )
浓硫酸与少量铜片反应的实验,下列是对实验操作、实验现象或解释等的有关记录,其中与事实不符或解释不合理的是( )
 浓硫酸与少量铜片反应的实验,下列是对实验操作、实验现象或解释等的有关记录,其中与事实不符或解释不合理的是( )
浓硫酸与少量铜片反应的实验,下列是对实验操作、实验现象或解释等的有关记录,其中与事实不符或解释不合理的是( )| A. | 实验开始时需给a试管稍微加热 | |
| B. | 反应开始时铜片表面可以看到有黑色物质生成 | |
| C. | 将a试管里的溶液冷却后注入盛有水的烧杯中,溶液呈蓝色 | |
| D. | b试管中的溶液逐渐褪为无色,说明反应生成的气体,将品红氧化为无色 |
19.在一定条件下的恒温恒容容器中,当下列物理量不再发生变化时,表明反应:A(s)+3B(g)?2C(g)+D(g)已达平衡状态的是( )
| A. | 混合气体的压强 | |
| B. | 混合气体的密度 | |
| C. | 单位时间内生成0.5molA的同时,消耗1molC | |
| D. | V(C正):V(D正)=2:1 |
6.为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.
Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出.为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验.可选用试剂:①KSCN溶液 ②NaOH溶液 ③酸性KMnO4溶液 ④K3[Fe(CN)6]溶液.
(1)请完成下表:
【实验结论】Fe的氧化产物为Fe2+和Fe3+
Ⅱ.AgNO3的热稳定性
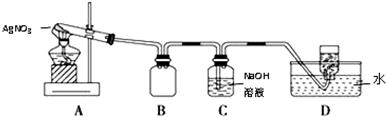
用如图所示的实验装置A加热固体,产生红棕色气体,在装置D中收集到无色气体.当反应结束以后,试管中残留固体为黑色.
(2)装置B的作用是安全瓶(或防止倒吸).
(3)经小组讨论并验证该无色气体为O2,其操作方法是用玻璃片盖住集气瓶口并取出,正放在桌面上,然后将带火星的木条伸入集气瓶内,若木条复燃则证明是O2.
(4)[查阅资料】①Ag2O和粉末的Ag均为黑色;②Ag2O可溶于氨水.
【提出假设】试管中残留的黑色固体可能是①Ag②Ag2O③Ag和Ag2O.
【实验验证】该小组为验证上述设想,分别取少量黑色固体,进行了如下实验:
【实验评价】根据上述实验,不能确定固体产物成分的实验是b(填实验编号).
【实验结论】根据上述实验结果,得出AgNO3固体受热分解的化学方程式为2AgNO3$\frac{\underline{\;\;△\;\;}}{\;}$2Ag+2NO2↑+O2↑.
【实验拓展】另取2.0g AgNO3样品充分受热分解,共收集到标准状况下气体的体积为336mL,则样品中AgNO3的百分含量为85%.
Ⅰ.AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出.为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验.可选用试剂:①KSCN溶液 ②NaOH溶液 ③酸性KMnO4溶液 ④K3[Fe(CN)6]溶液.
(1)请完成下表:
| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡 | 溶液变(血)红色 | 存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,加入1~2滴③或④(填序号)溶液,振荡 | 紫红色褪去或产生蓝色沉淀 | 存在Fe2+ |
Ⅱ.AgNO3的热稳定性
用如图所示的实验装置A加热固体,产生红棕色气体,在装置D中收集到无色气体.当反应结束以后,试管中残留固体为黑色.
(2)装置B的作用是安全瓶(或防止倒吸).
(3)经小组讨论并验证该无色气体为O2,其操作方法是用玻璃片盖住集气瓶口并取出,正放在桌面上,然后将带火星的木条伸入集气瓶内,若木条复燃则证明是O2.
(4)[查阅资料】①Ag2O和粉末的Ag均为黑色;②Ag2O可溶于氨水.
【提出假设】试管中残留的黑色固体可能是①Ag②Ag2O③Ag和Ag2O.
【实验验证】该小组为验证上述设想,分别取少量黑色固体,进行了如下实验:
| 实验编号 | 操 作 | 现 象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
【实验结论】根据上述实验结果,得出AgNO3固体受热分解的化学方程式为2AgNO3$\frac{\underline{\;\;△\;\;}}{\;}$2Ag+2NO2↑+O2↑.
【实验拓展】另取2.0g AgNO3样品充分受热分解,共收集到标准状况下气体的体积为336mL,则样品中AgNO3的百分含量为85%.

16.下列说法中正确的是( )
| A. | 主族元素的原子及其离子的核外电子层数等于该元素所在的周期数 | |
| B. | 元素周期表中从ⅢB到ⅡB族10个纵行的元素都是金属元素 | |
| C. | 稀有气体原子的最外层电子数都是8 | |
| D. | 互为同位素的元素物理性质、化学性质均相同 |
3.R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、n均为正整数)( )
| A. | 若R(OH)n为强碱,则W(OH)n+1也为强碱 | |
| B. | 若最高氧化物的水化物HnXOm为强酸,则Y是活泼非金属元素 | |
| C. | 若Y的最低化合价为-2,则Z的最高正化合价为+6 | |
| D. | 若X的最高正化合价为+5,则五种元素都是非金属元素 |
20.下列电子是正确的是( )
| A. | 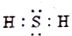 | B. | 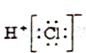 | C. | 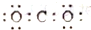 | D. | 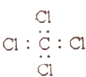 |