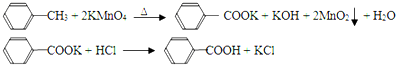
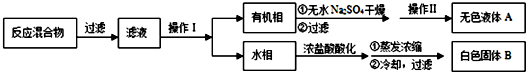
题目内容
10.常温下,将NO和O2两种气体按物质的量1:3混合,则其平均相对分子质量是( )| A. | 40.7 | B. | 46 | C. | 36 | D. | 44 |
分析 NO和O2两种气体按物质的量1:3混合,会发生化学反应,计算剩余的气体的组成,并根据M=m总n总计算平均相对分子质量即可.
解答 解:NO和O2两种气体按物质的量1:3混合,设NO是1mol,氧气是3mol,会发生化学反应2NO+O2=2NO2,所以得到的是2.5mol氧气和1mol二氧化氮,平均相对分子质量M=m总n总=2.5×32+1×463.5=36,
故选C.
点评 本题设计混合气体的有关计算知识,注意M=m总n总计算平均相对分子质量的方法是重点,难度不大.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
18.下列化学用语和叙述正确的是( )
| A. | M与N是同素异形体,由M=N;△H=+119kJ/mol可知,N比M稳定 | |
| B. | Na2O2的电子式: | |
| C. | 表示乙炔“燃烧热”对应的热化学方程式:C2H2 (g)+52O2 (g)═△2CO2 (g)+H2O(g)△H=-1 256kJ/mol | |
| D. | 葡萄糖的实验式:CH2O |
5.下列有机化合物分子中的所有碳原子不可能处于同一平面的是.
| A. | 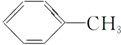 | B. | HC≡C-CH3 | ||
| C. | 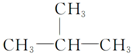 | D. |  |
15.在3L密闭容器中,充入1mol N2和3 mol H2并在一定条件下发生反应,20s后达到反应限度,测得混合气体总物质的量为3.4mol.下列计算结果正确的是( )
| A. | 20s后,混合气中n(H2):n(N2):n(NH3)=1:2:3 | |
| B. | N2的转化率为30% | |
| C. | 20s内H2的平均反应速率为1.5mol•L-1•s-1 | |
| D. | NH3的体积分数为25% |
2.X、Y、Z是三种短周期元素,在周期表中的相对位置如图所示,有关说法正确的是( )
| X | |
| Y | Z |
| A. | X、Y、Z可以都是金属 | |
| B. | 原子半径:Z>Y>X | |
| C. | 最高价氧化物对应的水化物酸性:Z>Y>X | |
| D. | 若X、Y、Z可形成  分子,则其中各原子都满足8电子结构 分子,则其中各原子都满足8电子结构 |
 ,写出一个能证明D、E两元素非金属性强弱的事实或反应方程式:Cl2+H2S=2HCl+S↓.
,写出一个能证明D、E两元素非金属性强弱的事实或反应方程式:Cl2+H2S=2HCl+S↓. (或
(或 ),其中含有的化学键为极性键(或极性键、非极性键)(填“极性键”“非极性键”“离子键”).(若有多种可能,只需答出其中一种物质)
),其中含有的化学键为极性键(或极性键、非极性键)(填“极性键”“非极性键”“离子键”).(若有多种可能,只需答出其中一种物质)