题目内容
3.X、Y和Z均为短周期元素,原子序数依次增大,X的单质为密度最小的气体,Y原子最外层电子数是其周期数的三倍,Z与X原子最外层电子数相同.回答下列问题:(1)X、Y的元素符号分别为H、O.
(2)由上述元素组成的化合物中,既有共价键又有离子键的有NaOH、Na2O2.
(3)X与Z可形成一种离子化合物,其与水能剧烈反应放出无色气体,对应的方程式为:NaH+H2O=NaOH+H2↑.
(4)X和Y组成的化合物中,既含有极性共价键又含有非极性共价键的是H2O2,该化合物的溶沸点较高的原因是:H2O2分子之间存在氢键;此化合物在酸性条件下与高锰酸钾反应产生一种无色气体,该反应的离子方程式为:2MnO4-+5H2O2+6H+=4Mn2++8H2O+5O2↑.
分析 X、Y和Z均为短周期元素,原子序数依次增大.X原子形成的单质是密度最小的气体,则X为H;Y原子的最外层电子数是其周期数的3倍,Y原子只能有2个电子层,最外层电子数为6,则Y为O;Z与X原子最外层电子数相同,原子序数大于盐,则Z是钠,据此答题.
解答 解:X、Y和Z均为短周期元素,原子序数依次增大.X原子形成的单质是密度最小的气体,则X为H;Y原子的最外层电子数是其周期数的3倍,Y原子只能有2个电子层,最外层电子数为6,则Y为O;Z与X原子最外层电子数相同,原子序数大于盐,则Z是钠.
(1)由上述分析可知,X为H元素、Y为O元素,故答案为:H;O;
(2)由H、O、Na元素组成的化合物中,既含有共价键又含有离子键的有NaOH、Na2O2,故答案为:NaOH;Na2O2;
(3)H与Na可形成一种离子化合物为NaH,其与水能剧烈反应放出无色气体,反应生成NaOH与氢气,对应的方程式为:NaH+H2O=NaOH+H2↑,
故答案为:NaH+H2O=NaOH+H2↑;
(3)H和O组成的化合物中,既含有极性共价键又含有非极性共价键的物质是H2O2,H2O2分子之间存在氢键,故其沸点较高,过氧化氢在酸性条件下与高锰酸钾反应产生一种无色气体,反应生成氧气,高锰酸根被还原为锰离子,反应的离子方程式为2MnO4-+5H2O2+6H+=4Mn2++8H2O+5O2↑,
故答案为:H2O2;H2O2分子之间存在氢键;2MnO4-+5H2O2+6H+=4Mn2++8H2O+5O2↑.
点评 本题考查结构与位置关系,推断元素是解题关键,需要学生熟练掌握元素化合物性质,侧重考查学生灵活运用知识解答问题能力,题目难度中等.

练习册系列答案
相关题目
18.下列化学用语和叙述正确的是( )
| A. | M与N是同素异形体,由M=N;△H=+119kJ/mol可知,N比M稳定 | |
| B. | Na2O2的电子式: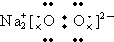 | |
| C. | 表示乙炔“燃烧热”对应的热化学方程式:C2H2 (g)+$\frac{5}{2}$O2 (g)═△2CO2 (g)+H2O(g)△H=-1 256kJ/mol | |
| D. | 葡萄糖的实验式:CH2O |
8.化学与社会、生活、生产密切相关.对下列现象或事实的解释正确的是( )
| 选项 | 现象或事实 | 解释 |
| A | 明矾用于净水 | 明矾具有消毒杀菌的作用 |
| B | 含硫煤中加入适量石灰石可减少对大气的污染 | 使煤燃烧产生的SO2最终生成CaSO4 |
| C | 钢铁在海水中比在河水中更易腐蚀 | 海水中含氧量高于河水 |
| D | “地沟油”可以用来制生物柴油 | 其主要成分和从石油中提取的柴油类似 |
| A. | A | B. | B | C. | C | D. | D |
15.在3L密闭容器中,充入1mol N2和3 mol H2并在一定条件下发生反应,20s后达到反应限度,测得混合气体总物质的量为3.4mol.下列计算结果正确的是( )
| A. | 20s后,混合气中n(H2):n(N2):n(NH3)=1:2:3 | |
| B. | N2的转化率为30% | |
| C. | 20s内H2的平均反应速率为1.5mol•L-1•s-1 | |
| D. | NH3的体积分数为25% |
12.CPAE是蜂胶的主要活性成分,也可由咖啡酸合成:下列说法不正确的是( )


| A. | 咖啡酸分子中所有原子可能处在同一个平面上 | |
| B. | 1 mol CPAE与足量的NaOH溶液反应,最多消耗3 mol NaOH | |
| C. | 可用金属Na检测上述反应是否残留苯乙醇 | |
| D. | 1 mol 苯乙醇在O2中完全燃烧,需消耗10 mol O2 |
13.某有机物的结构简式为 ,则该物质不能发生的反应有( )
,则该物质不能发生的反应有( )
 ,则该物质不能发生的反应有( )
,则该物质不能发生的反应有( )| A. | 加成反应 | B. | 消去反应 | C. | 取代反应 | D. | 加聚反应 |




 (1)有9种微粒:①NH2-;②-NH2;③Br-;④OH-;⑤-NO2;⑥-OH;⑦NO2;
(1)有9种微粒:①NH2-;②-NH2;③Br-;④OH-;⑤-NO2;⑥-OH;⑦NO2;