题目内容
9.已知A、B、C、D、E是短周期中原子序数一次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )| A. | 元素A、B组成的化合物常温下一定呈气态 | |
| B. | 一定条件下,元素C、D的最高价氧化物对应的水化物之间不能发生反应 | |
| C. | C、D、E的半径:C>D>E | |
| D. | 化合物AE与CE有相同类型的化学键 |
分析 元素B的原子最外层电子数是其电子层数的2倍,电子层数只可能是2,故B为C元素;A、B、C、D、E是短周期中原子序数依次增大,其中元素A、E的单质在常温下呈气态,则A的原子序数比C小,所以A为H元素,E为Cl元素;元素C在同周期的主族元素中原子半径最大,应位于同周期最左边,C为Na元素;元素D的合金是日常生活中常用的金属材料,则D为Al元素,结合选项分析.
解答 解:元素B的原子最外层电子数是其电子层数的2倍,电子层数只可能是2,故B为C元素,A的原子序数比B小且是气体,故A为H,元素 C 在同周期的主族元素中原子半径最大,应位于同周期最左边,C为Na元素、原子序数比钠大的金属,D为Al元素.
A.由C、H元素组成的化合物,比如苯在常温下呈液态,故A错误;
B.元素C、D对应的最高价氧化物对应的水化物为NaOH和Al(OH)3,二者之间反应生成偏铝酸钠和水,故B错误;
C.C为Na元素、D为Al元素、E为Cl元素,同为第三周期元素,同周期原子半径从左到右依次减小,则半径:C>D>E,故C正确;
D.化合物AE为HCl,为分子晶体,只有共价键,化合物CE为NaCl,是离子晶体,存在离子键,故D错误.
故选C.
点评 本题主要考查的原子结构与元素周期律的应用,考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力,题目难度不大.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
15.对下列有关物质同分异构体(不考虑立体异构)数目的分析中正确的是( )
| 选项 | 分子式 | 限定条件 | 数目 |
| A | C2H4O2 | 能与Na2CO3溶液反应 | 2 |
| B | C4H8Cl2 | 分子中有一个甲基 | 3 |
| C | C4H10O | 不能与钠反应 | 2 |
| D | C8H10 | 含有苯环 | 3 |
| A. | A | B. | B | C. | C | D. | D |
17.下列酸与碱中和反应热化学方程式可用:H+(aq)+OH-(aq)H2O(l)△H=-57.3kJ•mol-1来表示的是( )
| A. | CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l);△H=-Q1 kJ•mol-1 | |
| B. | $\frac{1}{2}$H2SO4(浓)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l);△H=-Q2 kJ•mol-1 | |
| C. | HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(l);△H=-Q3 kJ•mol-1 | |
| D. | $\frac{1}{3}$H3PO4(aq)+$\frac{1}{2}$Ba(OH)2(aq)═$\frac{1}{6}$Ba3(PO4)2(s)+H2O(l);△H=-Q4 kJ•mol-1 |
14.下列事实,不能用勒夏特列原理解释的是( )
| A. | 溴水中有平衡:Br2+H2O=HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 | |
| B. | 在电解含有酚酞的硫酸钠溶液时,阴极附近溶液的颜色变红 | |
| C. | 对CO+NO2=CO2+NO,平衡体系增大压强可使颜色变深 | |
| D. | 合成NH3反应,为提高NH3的产率,理论上应采取相对较低温度的措施 |
1.下列物质的电子式书写正确的是( )
①Ca(OH)2
 ②H2S
②H2S 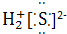
③OH-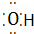 ④Al3+ Al3+ ⑤N2 N$\underset{\stackrel{•}{•}}{•}$ $\underset{\stackrel{•}{•}}{•}$N
④Al3+ Al3+ ⑤N2 N$\underset{\stackrel{•}{•}}{•}$ $\underset{\stackrel{•}{•}}{•}$N
⑥CO2 ⑦HClO
⑦HClO 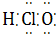 ⑧Na2O2
⑧Na2O2 
①Ca(OH)2

 ②H2S
②H2S 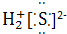
③OH-
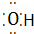 ④Al3+ Al3+ ⑤N2 N$\underset{\stackrel{•}{•}}{•}$ $\underset{\stackrel{•}{•}}{•}$N
④Al3+ Al3+ ⑤N2 N$\underset{\stackrel{•}{•}}{•}$ $\underset{\stackrel{•}{•}}{•}$N⑥CO2
 ⑦HClO
⑦HClO 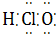 ⑧Na2O2
⑧Na2O2 
| A. | ①②③④ | B. | ⑤⑥⑦⑧ | C. | ②③⑤⑥⑦ | D. | ①④⑧ |
18.下列有关化学反应速率的说法中,正确的是( )
| A. | 100 mL 2 mol/L的盐酸与锌反应时,加入3mol/L的氯化钠溶液,生成氢气的速率不变 | |
| B. | 用铁片和稀硫酸反应制取氢气,改用铁片和浓硫酸可以加快产生氢气的速率 | |
| C. | 在做草酸与高锰酸钾的反应时,加入少量硫酸锰固体可加快溶液褪色速率 | |
| D. | 500mL 1mol/L的稀HCl与锌粒反应,将500mL 1mol/L的HCl改为1000mL 1mol/L的盐酸会使反应速率减慢 |
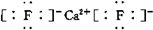 ;若XY2为共价化合物时,其结构式为:S=C=S.
;若XY2为共价化合物时,其结构式为:S=C=S.
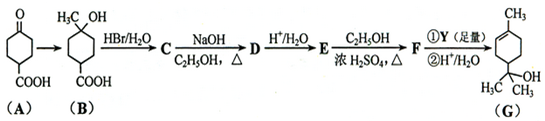
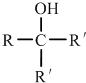
 .①核磁共振氢谱有2个吸收峰 ②能发生银镜反应
.①核磁共振氢谱有2个吸收峰 ②能发生银镜反应 .
. .
.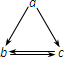 下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )