题目内容
15.有Fe2++H++NO3-→Fe3++NH4++H2O这样一个变化过程,下列叙述不正确的是( )| A. | 氧化剂和还原剂的物质的量之比为1:8 | |
| B. | 该过程说明Fe(NO3)2溶液不宜加酸酸化 | |
| C. | 每1 mol NO3-发生氧化反应,转移8 mol 电子 | |
| D. | 若把该反应设计为原电池,则负极反应为Fe2+-e-═Fe3+ |
分析 A.该反应中Fe元素化合价由+2价变为+3价、N元素化合价由+5价变为-3价,所以亚铁离子是还原剂、NO3-是氧化剂,根据转移电子相等判断氧化剂和还原剂的物质的量之比;
B.酸性条件下,NO3-能氧化亚铁离子生成铁离子;
C.该反应中NO3-中N元素得电子发生还原反应;
D.如果把该反应设计为原电池,负极上失电子发生氧化反应.
解答 解:A.该反应中Fe元素化合价由+2价变为+3价、N元素化合价由+5价变为-3价,所以亚铁离子是还原剂、NO3-是氧化剂,每个亚铁离子失去1个电子、每个NO3-得到8个电子,根据转移电子相等判断氧化剂和还原剂的物质的量之比1:8,故A正确;
B.根据离子方程式知,酸性条件下,NO3-能氧化亚铁离子生成铁离子,所以Fe(NO3)2溶液不宜加酸酸化,否则易变质,故B正确;
C.该反应中NO3-中N元素得电子发生还原反应,不是发生氧化反应,故C错误;
D.如果把该反应设计为原电池,负极上失电子发生氧化反应,电极反应式为Fe2+-e-═Fe3+,故D正确;
故选C.
点评 本题考查氧化还原反应,涉及反应类型判断、电极反应式的书写、物质的量的计算等知识点,明确物质性质与元素化合价的关系即可解答,易错选项是C.

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案
相关题目
5.有关二氧化硫的叙述正确的是( )
| A. | 二氧化硫不能使溴水、高锰酸钾溶液迅速褪色 | |
| B. | 接触法制硫酸的沸腾炉排出的炉气中含SO2 | |
| C. | 实验室可用启普发生器制取二氧化硫 | |
| D. | 用石灰水很容易区分二氧化碳和二氧化硫 |
10.下列化学方程式或离子方程式正的( )
| A. | 乙酸与碳酸钠溶液反应的离子方程式:2H++CO32-═CO2↑+H2O | |
| B. | 苯酚钠溶液中通入少量二氧化碳的离子方程式:2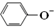 +H2O+CO2→2 +H2O+CO2→2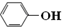 +CO32- +CO32- | |
| C. | 丙烯聚合成聚丙烯的化学方程式:nCH2=CHCH3$\stackrel{催化剂}{→}$  | |
| D. | 乙醛溶液与足量的银氨溶液共热的化学方程式:CH3CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH3COONH4+2Ag↓+3NH3+H2O? |
20.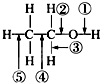 乙醇分子中的各种化学键如图所示,下列关于乙醇在各种反应中断裂键的说明不正确的是( )
乙醇分子中的各种化学键如图所示,下列关于乙醇在各种反应中断裂键的说明不正确的是( )
 乙醇分子中的各种化学键如图所示,下列关于乙醇在各种反应中断裂键的说明不正确的是( )
乙醇分子中的各种化学键如图所示,下列关于乙醇在各种反应中断裂键的说明不正确的是( )| A. | 和金属钠反应时①键断裂 | |
| B. | 和乙酸发生酯化反应时②键断裂 | |
| C. | 在铜催化及加热条件下与O2反应时断裂①键和⑤键 | |
| D. | 在空气中完全燃烧时断裂①②③④⑤键 |
7.利用原电池原理可以探究金属的活动性.
(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计.锌片做负极(填“正”或“负”),银片上发生的电极反应式是2H++2e-=H2↑.
(2)若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47g.此时产生标准状况下氢气的体积为4.48L,通过导线的电子的物质的量为0.4mol.
(3)为证明铁的金属活动性比铜强,某同学设计了如下一些方案.其中能证明铁的金属活动性比铜强的方案是①③④.(填序号)
(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计.锌片做负极(填“正”或“负”),银片上发生的电极反应式是2H++2e-=H2↑.
(2)若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47g.此时产生标准状况下氢气的体积为4.48L,通过导线的电子的物质的量为0.4mol.
(3)为证明铁的金属活动性比铜强,某同学设计了如下一些方案.其中能证明铁的金属活动性比铜强的方案是①③④.(填序号)
| 方 案 | 现象或产物 |
| ①将铁片置于CuSO4溶液中 | 铁片上有亮红色物质析出 |
| ②将铁丝和铜丝分别在氯气燃烧 | 产物分别为FeCl3和CuCl2 |
| ③将铁片和铜片分别置于稀硫酸溶液中 | 铁片上有气泡产生,铜片上无气泡产生 |
| ④将铁片和铜片置于盛有稀硫酸的烧杯中,并用导线连接 | 铁片溶解,铜片上有气泡产生 |
