题目内容
5.有关二氧化硫的叙述正确的是( )| A. | 二氧化硫不能使溴水、高锰酸钾溶液迅速褪色 | |
| B. | 接触法制硫酸的沸腾炉排出的炉气中含SO2 | |
| C. | 实验室可用启普发生器制取二氧化硫 | |
| D. | 用石灰水很容易区分二氧化碳和二氧化硫 |
分析 A.二氧化硫具有还原性,能被强氧化剂氧化;
B.含硫物质在沸腾炉中发生反应生成二氧化硫,同时通入过量空气,所以从沸腾炉排出的气体中含有二氧化硫、氮气等;
C.实验室用亚硫酸钠和硫酸制取二氧化硫,硫酸钠是粉末状固体;
D.二氧化硫、二氧化碳都能使澄清石灰水变浑浊.
解答 解:A.二氧化硫具有还原性,能被强氧化剂氧化,溴和高锰酸钾溶液都具有强氧化性,所以二氧化硫能被溴水、高锰酸钾溶液氧化而使酸性、高锰酸钾溶液褪色,故A错误;
B.含硫物质在沸腾炉中发生反应生成二氧化硫,同时通入过量空气,所以从沸腾炉排出的气体中含有二氧化硫、氮气等,故B正确;
C.启普发生器制取气体时,药品必须是块状固体和溶液,且不需要加热,实验室用亚硫酸钠和硫酸制取二氧化硫,硫酸钠是粉末状固体,所以实验室不可用启普发生器制取二氧化硫,故C错误;
D.二氧化硫、二氧化碳都能使澄清石灰水变浑浊,所以不能用澄清石灰水鉴别二氧化硫、二氧化碳,可以用品红溶液鉴别,故D错误;
故选B.
点评 本题考查仪器选取、物质鉴别、物质性质等知识点,综合性较强,明确元素化合物性质及仪器的使用条件是解本题关键,易错选项是D.

练习册系列答案
相关题目
15.下列关于氯化铵溶液的说法正确的是( )
| A. | 升高温度,氯化铵水解程度增大 | |
| B. | 水解平衡向右移动,溶液的pH一定减小 | |
| C. | 向溶液中加入氯化钠固体,能抑制氯化铵的电离 | |
| D. | 向溶液中加入氯化铵固体,水解平衡向右移动,水解程度增大 |
16.下列每组物质发生所述变化克服的作用属于同种类型的是( )
| A. | 氯化铝和干冰升华 | B. | 钠和硫熔化 | ||
| C. | 食盐和氯化氢溶解于水 | D. | 二氧化硅和二氧化硫熔化 |
13.用铝粉和四氧化三铁配成铝热剂,分成两等份:一份在高温下恰好完全反应,再与足量稀硫酸反应,生成H2aL,另一份直接与足量的氢氧化钠充分反应,在相同条件下产生H2 bL 则a:b等于( )
| A. | 1:1 | B. | 3:4 | C. | 4:3 | D. | 9:8 |
20.温度为T0时,在恒容的密闭容器中发生反应,各物质的浓度随时间变化的关系如图a所示.其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示.下列叙述正确的是( )
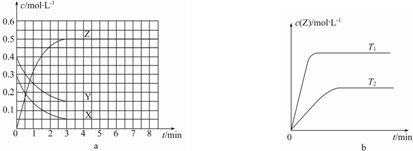

| A. | 该反应的正反应是放热反应 | |
| B. | 若在第6 min时升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| C. | 图a中反应达到平衡时,Y的转化率为37.5% | |
| D. | 反应中某时刻各物质的正反应速率为2v(X)═2v(Y)═v(Z) |
17.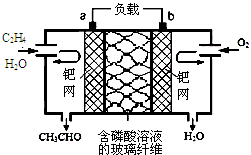 乙烯催化氧化生成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2═CH2+O2→2CH3CHO.下列有关说法正确的是( )2.
乙烯催化氧化生成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2═CH2+O2→2CH3CHO.下列有关说法正确的是( )2.
 乙烯催化氧化生成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2═CH2+O2→2CH3CHO.下列有关说法正确的是( )2.
乙烯催化氧化生成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2═CH2+O2→2CH3CHO.下列有关说法正确的是( )2.| A. | 该电池可以实现化学能和电能的相互转化 | |
| B. | 电子移动方向:电极a→磷酸溶液→电极b | |
| C. | 正极反应式为:O2+4e-+2H2O═4OH- | |
| D. | 每有1mol 乙烯反应,则迁移2 mol H+ |
14.用下列实验装置进行相应实验,能达到实验目的是( )
| A. | 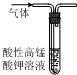 除去CO2中混有的SO2 | B. | 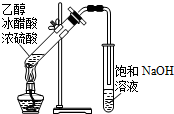 制取较纯净的乙酸乙酯 | ||
| C. | 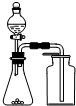 用生石灰和浓氨水制取氨气 | D. | 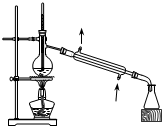 分离苯和四氯化碳的混合物 |
15.有Fe2++H++NO3-→Fe3++NH4++H2O这样一个变化过程,下列叙述不正确的是( )
| A. | 氧化剂和还原剂的物质的量之比为1:8 | |
| B. | 该过程说明Fe(NO3)2溶液不宜加酸酸化 | |
| C. | 每1 mol NO3-发生氧化反应,转移8 mol 电子 | |
| D. | 若把该反应设计为原电池,则负极反应为Fe2+-e-═Fe3+ |