题目内容
7.利用原电池原理可以探究金属的活动性.(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计.锌片做负极(填“正”或“负”),银片上发生的电极反应式是2H++2e-=H2↑.
(2)若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47g.此时产生标准状况下氢气的体积为4.48L,通过导线的电子的物质的量为0.4mol.
(3)为证明铁的金属活动性比铜强,某同学设计了如下一些方案.其中能证明铁的金属活动性比铜强的方案是①③④.(填序号)
| 方 案 | 现象或产物 |
| ①将铁片置于CuSO4溶液中 | 铁片上有亮红色物质析出 |
| ②将铁丝和铜丝分别在氯气燃烧 | 产物分别为FeCl3和CuCl2 |
| ③将铁片和铜片分别置于稀硫酸溶液中 | 铁片上有气泡产生,铜片上无气泡产生 |
| ④将铁片和铜片置于盛有稀硫酸的烧杯中,并用导线连接 | 铁片溶解,铜片上有气泡产生 |
分析 (1)该原电池中,Zn易失电子作负极,Ag作正极,正极上氢离子得电子发生还原反应;
(2)该原电池中,负极上锌溶解、正极上生成氢气,所以负极质量减少、正极质量不变,则反应前后电极质量减少的量是锌的质量,根据转移电子相等计算生成氢气体积;根据锌和转移电子之间的关系式计算转移电子物质的量;
(3)金属的金属活动性越强,其单质的还原性越强,金属单质与酸或水反应越剧烈,较活泼金属能从较不活泼金属盐溶液中置换出来,一般来说原电池中较活泼金属作负极、较不活泼金属作正极.
解答 解:(1)该原电池中,Zn易失电子作负极,Ag作正极,正极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑,故答案为:负;2H++2e-=H2↑;
(2)该原电池中,负极上锌溶解、正极上生成氢气,所以负极质量减少、正极质量不变,则反应前后电极质量减少的量是锌的质量,则参加反应的锌的质量=(60-47)g=13g,其物质的量=13g÷65g/mol=0.2mol,根据转移电子相等得生成氢气体积=$\frac{0.2mol×2}{2}×22.4L/mol$=4.48L;根据锌和转移电子之间的关系式得转移电子物质的量=0.2mol×2=0.4mol,
故答案为:4.48;0.4;
(3)金属的金属活动性越强,其单质的还原性越强,金属单质与酸或水反应越剧烈,较活泼金属能从较不活泼金属盐溶液中置换出来,一般来说原电池中较活泼金属作负极、较不活泼金属作正极,
①将铁片置于CuSO4溶液中,铁片上有亮红色物质析出,说明铁能置换出Cu,则金属活动性Fe>Cu,故正确;
②金属的活动性强弱与失电子多少无关,所以不能据此判断金属性强弱,故错误;
③将铁片和铜片分别置于稀硫酸溶液中,铁片上有气泡产生,铜片上无气泡产生,说明铁能置换出氢气、Cu不能,则金属活动性Fe>Cu,故正确;
④将铁片和铜片置于盛有稀硫酸的烧杯中,并用导线连接,铁片溶解,铜片上有气泡产生,则Fe作负极、Cu作正极,所以金属活动性Fe>Cu,故正确;
故答案为:①③④.
点评 本题考查原电池原理及金属活动性强弱判断,侧重考查基本原理,明确正负极的判断方法是解本题关键,知道金属活动性强弱与失电子难易程度有关,与失电子多少无关,易错选项是(3)②.

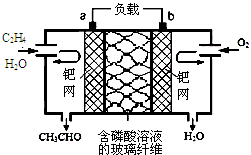 乙烯催化氧化生成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2═CH2+O2→2CH3CHO.下列有关说法正确的是( )2.
乙烯催化氧化生成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2═CH2+O2→2CH3CHO.下列有关说法正确的是( )2.| A. | 该电池可以实现化学能和电能的相互转化 | |
| B. | 电子移动方向:电极a→磷酸溶液→电极b | |
| C. | 正极反应式为:O2+4e-+2H2O═4OH- | |
| D. | 每有1mol 乙烯反应,则迁移2 mol H+ |
| A. | 氧化剂和还原剂的物质的量之比为1:8 | |
| B. | 该过程说明Fe(NO3)2溶液不宜加酸酸化 | |
| C. | 每1 mol NO3-发生氧化反应,转移8 mol 电子 | |
| D. | 若把该反应设计为原电池,则负极反应为Fe2+-e-═Fe3+ |
| A. | 氮气的电子式: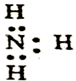 | B. | N2的结构式:N≡N | ||
| C. | 乙酸的结构简式:C2H4O2 | D. | CH4分子的球棍模型: |
| A. | 标准状况下,11.21的己烷所含的分子数为0.5 NA | |
| B. | 28g乙烯所含共用电子对数目为4 NA | |
| C. | 1mol苯乙烯中含有的C=C数为4NA | |
| D. | 2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA |
5C+4 MnO4-+12 H+-5 CO2↑+4 Mn2++6H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中.进行反应CO(g )+H2O(g)?CO2(g)+H2(g)得到如下两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
②该反应为放(填“吸”或“放”)热反应,实验2中达平衡时 CO的转化率为20%.
(3)在容积可变的密闭容器中发生反应:mA(g)+nB(g)?pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol•L-1 | 0.08 | 0.20 | 0.44 |
②当压强从5×105 Pa增加到1×106Pa时,该反应平衡常数表达式为K=$\frac{[C]^{p}}{[A]{\;}^{m}}$.(4)在25℃下,向浓度为0.1mol•L-1的FeCl3溶液中逐滴加入氨水,调节溶液pH为 5时,溶液中c(Fe3+)为4×10-11mol/L.(已知25℃时 Ksp[Fe(OH)3]=4×10-38)
| A. | 在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量 | |
| B. | 根据原子核外电子排布的特点,Cu属于s区元素 | |
| C. | 因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 | |
| D. | 核外电子排布由1s22s22p63s1-→1s22s22p6 的变化需要吸收能量 |
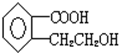
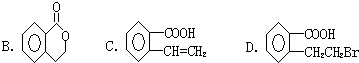
 .
.
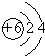 ;元素②的最高价氧化物结构式为:O=C=0;
;元素②的最高价氧化物结构式为:O=C=0;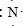 →
→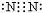 .
.