题目内容
6.富马酸(HOOC-CH=CH-COOH)的学名为丁烯二酸,是生产药物喹硫平的原料之一,它的合成路线如下:
(1)富马酸中有2种化学环境不同的氢原子.
(2)反应②反应条件是氢氧化钠水溶液、加热.
(3)流程中设计反应③⑤的目的是保护碳碳双键,防止被氧化.
(4)E→F的化学方程式为HOOCCH2CHBrCOOH+3NaOH$→_{△}^{醇}$NaOOCCH2CH(OH)COONa+NaBr+2H2O,反应类型是消去反应.
分析 对比A、C的结构,可知A与溴发生1,4-加成生成B为BrCH2CH=CHCH2Br,B在氢氧化钠水溶液、加热条件下发生水解反应生成C,C与HBr发生加成反应生成D为HOCH2CH2CHBrCH2OH,D被酸性高锰酸钾氧化生成E为HOOCCH2CHBrCOOH,E在氢氧化钠醇溶液、加热条件下发生卤代烃水解反应、中和反应,反应生成F为NaOOCCH2CH(OH)COONa,F酸性条件下发生酯的消去反应,同时酸化得到HOOC-CH=CH-COOH,据此解答.
解答 解:对比A、C的结构,可知A与溴发生1,4-加成生成B为BrCH2CH=CHCH2Br,B在氢氧化钠水溶液、加热条件下发生水解反应生成C,C与HBr发生加成反应生成D为HOCH2CH2CHBrCH2OH,D被酸性高锰酸钾氧化生成E为HOOCCH2CHBrCOOH,E在氢氧化钠醇溶液、加热条件下发生卤代烃水解反应、中和反应,反应生成F为NaOOCCH2CH(OH)COONa,F酸性条件下发生酯的消去反应,同时酸化得到HOOC-CH=CH-COOH.
(1)富马酸为对称结构,分子中有2种化学环境不同的氢原子,故答案为:2;
(2)反应②发生卤代烃的水解反应,反应条件是:氢氧化钠水溶液、加热,故答案为:氢氧化钠水溶液、加热;
(3)反应④中酸性高锰酸钾氧化羟基,也可以氧化碳碳双键,流程中设计反应③⑤的目的是:保护碳碳双键,防止被氧化,故答案为:保护碳碳双键,防止被氧化;
(4)E→F的化学方程式为:HOOCCH2CHBrCOOH+3NaOH$→_{△}^{醇}$NaOOCCH2CH(OH)COONa+NaBr+2H2O,属于消去反应,
故答案为:HOOCCH2CHBrCOOH+3NaOH$→_{△}^{醇}$NaOOCCH2CH(OH)COONa+NaBr+2H2O;消去反应.
点评 本题考查有机物的推断,结合有机物的结构与反应条件,利用顺推法进行推断,需要学生熟练掌握官能团的性质与转化,难度不大.

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案| A. | 氯化铝和干冰升华 | B. | 钠和硫熔化 | ||
| C. | 食盐和氯化氢溶解于水 | D. | 二氧化硅和二氧化硫熔化 |
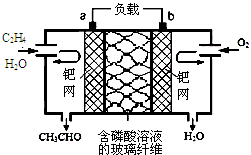 乙烯催化氧化生成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2═CH2+O2→2CH3CHO.下列有关说法正确的是( )2.
乙烯催化氧化生成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2═CH2+O2→2CH3CHO.下列有关说法正确的是( )2.| A. | 该电池可以实现化学能和电能的相互转化 | |
| B. | 电子移动方向:电极a→磷酸溶液→电极b | |
| C. | 正极反应式为:O2+4e-+2H2O═4OH- | |
| D. | 每有1mol 乙烯反应,则迁移2 mol H+ |
| A. | 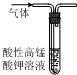 除去CO2中混有的SO2 | B. | 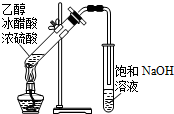 制取较纯净的乙酸乙酯 | ||
| C. | 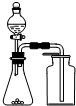 用生石灰和浓氨水制取氨气 | D. | 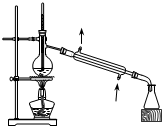 分离苯和四氯化碳的混合物 |
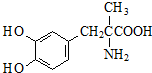
| A. | 分子式为C10H14NO4 | |
| B. | 分子中有一个手性碳原子 | |
| C. | 甲基多巴具有两性,且能发生酯化反应 | |
| D. | 1mol甲基多巴分子最多能与2 mol NaOH反应 |
| A. | 氧化剂和还原剂的物质的量之比为1:8 | |
| B. | 该过程说明Fe(NO3)2溶液不宜加酸酸化 | |
| C. | 每1 mol NO3-发生氧化反应,转移8 mol 电子 | |
| D. | 若把该反应设计为原电池,则负极反应为Fe2+-e-═Fe3+ |
5C+4 MnO4-+12 H+-5 CO2↑+4 Mn2++6H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中.进行反应CO(g )+H2O(g)?CO2(g)+H2(g)得到如下两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
②该反应为放(填“吸”或“放”)热反应,实验2中达平衡时 CO的转化率为20%.
(3)在容积可变的密闭容器中发生反应:mA(g)+nB(g)?pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol•L-1 | 0.08 | 0.20 | 0.44 |
②当压强从5×105 Pa增加到1×106Pa时,该反应平衡常数表达式为K=$\frac{[C]^{p}}{[A]{\;}^{m}}$.(4)在25℃下,向浓度为0.1mol•L-1的FeCl3溶液中逐滴加入氨水,调节溶液pH为 5时,溶液中c(Fe3+)为4×10-11mol/L.(已知25℃时 Ksp[Fe(OH)3]=4×10-38)
 .
.