题目内容
20.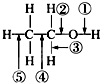 乙醇分子中的各种化学键如图所示,下列关于乙醇在各种反应中断裂键的说明不正确的是( )
乙醇分子中的各种化学键如图所示,下列关于乙醇在各种反应中断裂键的说明不正确的是( )| A. | 和金属钠反应时①键断裂 | |
| B. | 和乙酸发生酯化反应时②键断裂 | |
| C. | 在铜催化及加热条件下与O2反应时断裂①键和⑤键 | |
| D. | 在空气中完全燃烧时断裂①②③④⑤键 |
分析 A.乙醇和钠反应生成氢气,氢氧键断裂;
B.和乙酸反应生成乙酸乙酯,O-H键断裂;
C.乙醇在铜催化下与O2反应生成乙醛和水,断开的是羟基上的氢氧键和与羟基所连的碳的氢;
D.在空气中完全燃烧时生成二氧化碳和水.
解答 解:A.乙醇和钠反应生成氢气,断开的羟基上的氢氧键,即①键,故A正确;
B.和乙酸反应生成乙酸乙酯,O-H键断裂,即①断裂,故B错误;
C.乙醇在铜催化下与O2反应生成乙醛和水,断开的是羟基上的氢氧键和与羟基所连的碳的氢,即①③断裂,故C错误;
D.在空气中完全燃烧时生成二氧化碳和水,则断裂①②③④⑤,故D正确;
故选BC.
点评 本题考查有机物的结构与性质,侧重乙醇性质的考查,注意乙醇的性质与官能团、化学键的关系,注重基础知识的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.下列关系正确的是( )
| A. | 熔点:戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷 | |
| B. | 密度:CHCl3>H2O>己烷 | |
| C. | 氢元素质量分数:甲烷>乙烷>乙烯>乙炔>苯 | |
| D. | 等质量物质完全燃烧耗O2量:苯>环已烷>已烷 |
15.有Fe2++H++NO3-→Fe3++NH4++H2O这样一个变化过程,下列叙述不正确的是( )
| A. | 氧化剂和还原剂的物质的量之比为1:8 | |
| B. | 该过程说明Fe(NO3)2溶液不宜加酸酸化 | |
| C. | 每1 mol NO3-发生氧化反应,转移8 mol 电子 | |
| D. | 若把该反应设计为原电池,则负极反应为Fe2+-e-═Fe3+ |
5.(1)在100℃时,将0.400mol的二氧化氮气体充入2L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
①在上述条件下,从反应开始直至20s时,二氧化氮的平均反应速率为0.15 mol/(L•min).
②n3=n4(填“>”、“<”或“=”)
(2)氧族元素单质与H2反应情况:
工业上Al2Te3可用来制备H2Te,完成下列化学方程式并配平:
1Al2Te3+6H2O═2Al(OH)3↓+3H2Te↑
(3)美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型电源,其构造如图所示:a、b两个电极均由多孔的碳块组成,通人的氢气和氧气由孔隙中逸出,并在电极表面发生电极反应而放电.

其电极分别为a是负极,(填正或负),若介质为KOH溶液,其电极反应分别是:
a极:H2-2e-+2OH-=2H2Ob极:O2+4e-+2H2O=4OH-.
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
②n3=n4(填“>”、“<”或“=”)
(2)氧族元素单质与H2反应情况:
| 元素 | O | S | Se | Te |
| 单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
1Al2Te3+6H2O═2Al(OH)3↓+3H2Te↑
(3)美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型电源,其构造如图所示:a、b两个电极均由多孔的碳块组成,通人的氢气和氧气由孔隙中逸出,并在电极表面发生电极反应而放电.

其电极分别为a是负极,(填正或负),若介质为KOH溶液,其电极反应分别是:
a极:H2-2e-+2OH-=2H2Ob极:O2+4e-+2H2O=4OH-.
12.下列化学用语或模型正确的是( )
| A. | 氮气的电子式: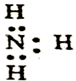 | B. | N2的结构式:N≡N | ||
| C. | 乙酸的结构简式:C2H4O2 | D. | CH4分子的球棍模型: |