题目内容
10.下列化学方程式或离子方程式正的( )| A. | 乙酸与碳酸钠溶液反应的离子方程式:2H++CO32-═CO2↑+H2O | |
| B. | 苯酚钠溶液中通入少量二氧化碳的离子方程式:2 +H2O+CO2→2 +H2O+CO2→2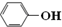 +CO32- +CO32- | |
| C. | 丙烯聚合成聚丙烯的化学方程式:nCH2=CHCH3$\stackrel{催化剂}{→}$ 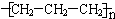 | |
| D. | 乙醛溶液与足量的银氨溶液共热的化学方程式:CH3CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH3COONH4+2Ag↓+3NH3+H2O? |
分析 A.乙酸为弱电解质,离子方程式中不能拆开,应该保留分子式;
B.苯酚的酸性大于碳酸氢根离子,二者反应生成苯酚和碳酸氢根离子;
C.聚丙烯的结构简式错误,聚丙烯的主链上应该含有2个C;
D.乙醛分子中含有醛基,能够与银氨溶液发生银镜反应.
解答 解:A.乙酸与碳酸钠溶液反应,乙酸不能拆开,正确的离子方程式为:2CH3COOH+CO32-═CO2↑+H2O+2CH3COO-,故A错误;
B.苯酚钠溶液中通入少量二氧化碳,反应生成苯酚和碳酸氢钠,正确的离子方程式为: +H2O+CO2→
+H2O+CO2→ +HCO3-,故B错误;
+HCO3-,故B错误;
C.丙烯分子中含碳碳双键,可发生加聚反应生成聚丙烯,正确的化学方程式为: ,故C错误;
,故C错误;
D.乙醛溶液与足量的银氨溶液共热的化学方程式为:CH3CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH3COONH4+2Ag↓+3NH3+H2O,故D正确;
故选D.
点评 本题考查了离子方程式、化学方程式的判断,为高考中的高频题,属于中等难度的试题,注意掌握离子方程式、化学方程式的书写原则,明确其正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
20.温度为T0时,在恒容的密闭容器中发生反应,各物质的浓度随时间变化的关系如图a所示.其他条件相同,温度分别为T1、T2时发生反应,Z的浓度随时间变化的关系如图b所示.下列叙述正确的是( )
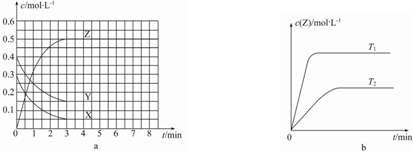

| A. | 该反应的正反应是放热反应 | |
| B. | 若在第6 min时升高温度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| C. | 图a中反应达到平衡时,Y的转化率为37.5% | |
| D. | 反应中某时刻各物质的正反应速率为2v(X)═2v(Y)═v(Z) |
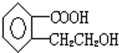
1.甲基多巴是一种降压药,其结构如图所示,下列有关说法正确的是( )


| A. | 分子式为C10H14NO4 | |
| B. | 分子中有一个手性碳原子 | |
| C. | 甲基多巴具有两性,且能发生酯化反应 | |
| D. | 1mol甲基多巴分子最多能与2 mol NaOH反应 |
5.用括号内试剂及操作方法除去下列各物质中的少量杂质,不正确的是( )
| A. | 苯中的甲苯(溴水、分液) | B. | 溴乙烷中的乙醇(水、分液) | ||
| C. | 乙醇中的水(CaO、蒸馏) | D. | 溴苯中的溴(NaOH溶液、分液) |
15.有Fe2++H++NO3-→Fe3++NH4++H2O这样一个变化过程,下列叙述不正确的是( )
| A. | 氧化剂和还原剂的物质的量之比为1:8 | |
| B. | 该过程说明Fe(NO3)2溶液不宜加酸酸化 | |
| C. | 每1 mol NO3-发生氧化反应,转移8 mol 电子 | |
| D. | 若把该反应设计为原电池,则负极反应为Fe2+-e-═Fe3+ |
19.NA为阿伏伽德罗常数,下列说法正确的是( )
| A. | 标准状况下,11.21的己烷所含的分子数为0.5 NA | |
| B. | 28g乙烯所含共用电子对数目为4 NA | |
| C. | 1mol苯乙烯中含有的C=C数为4NA | |
| D. | 2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA |
15.下列变化过程中,化学键没有被破坏的是( )
| A. | HCl溶于水 | B. | 干冰升华 | ||
| C. | 固体NaCl熔融 | D. | 煤矿中瓦斯(主要成分CH4)遇火爆炸 |

 .
.
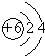 ;元素②的最高价氧化物结构式为:O=C=0;
;元素②的最高价氧化物结构式为:O=C=0;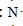 →
→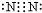 .
.