题目内容
3.许多金属及它们的化合物在科学研究和工业生产中具有许多用途,回答下列问题:(1)铁元素在周期表中的位置第四周期第VIII族,试从电子排布角度解释Fe2+易被氧化成Fe3+原因:Fe2+的价电子3d6失去一个电子可形成3d5半充满稳定结构.
(2)CO与N2结构相似,CO分子内σ键与π键个数之比为1:2;配合物Ni(CO)n的中心原子价电子数与配体提供配位电子总数之和为18,则n=4.
(3)NiO、FeO的晶体结构类型均与氯化钠的相同,回答:
①Ni2+和Fe2+的离子半径分别为0.069nm和0.078nm,则熔点NiO>FeO(填“<”或“>”).
②NiO晶体中Ni的配位数为6.
(4)金属Cu2O为半导体材料,与稀硫酸反应得到蓝色溶液及一种单质,写出该反应的离子方程式为Cu2O+2H+=Cu2++Cu+H2O.
(5)一种铜金合金晶体具有面心立方最密堆积的结构,在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为1:3.
分析 (1)铁的原子序数为26,在周期表中处于第四周期第VIII族;结构亚铁离子和铁离子的电子排布式进行判断;
(2)CO与N2结构相似,应含有C≡O键;
②Ni的家电子数为10,每个配体提供一个电子对,根据10+2n=18计算;
(3)①影响离子晶体的因素有电荷因素和半径因素;
②NaCl中钠离子的配位数为6;
(4)根据化合价变化可知,氧化亚铜和稀硫酸反应生成硫酸铜、Cu和水,据此写出反应的离子方程式;
(5)利用均摊法计算两种金属原子个数之比.
解答 解:(1)铁为26号元素,元素在周期表中位于第四周期Ⅷ族;由于Fe2+的价电子3d6失去一个电子可形成3d5半充满稳定结构,所以Fe2+易被氧化成Fe3+,
故答案为:第四周期Ⅷ族;Fe2+的价电子3d6失去一个电子可形成3d5半充满稳定结构;
(2)①CO与N2结构相似,含有C≡O键,含有1个σ键,2个π键,CO分子内σ键与π键个数之比为1:2,
故答案为:1:2;
②Ni的家电子数为10,每个配体提供一个电子对,则10+2n=18,n=4,
故答案为:4;
(3)①Ni2+和Fe2+的离子半径分别为69pm和78pm,离子半径越小,离子键作用力越大,晶体的熔沸点越高,所以熔点NiO>FeO,
故答案为:>;
②NaCl中钠离子和氯离子的配位数分别为6,NiO的晶体结构类型与氯化钠的相同,NiO晶胞中Ni和O的配位数分别为6,
故答案为:6;
(4)Cu2O与稀硫酸反应得到蓝色溶液及一种单质,根据氧化还原反应中化合价变化可知,氧化亚铜和稀硫酸反应生成硫酸铜、Cu和水,反应的离子方程式为:Cu2O+2H+=Cu2++Cu+H2O,
故答案为:Cu2O+2H+=Cu2++Cu+H2O;
(5)在晶胞中,Au原子位于顶点,Cu原子位于面心,该晶胞中Au原子个数=8×$\frac{1}{8}$=1,Cu原子个数=6×$\frac{1}{2}$=3,所以该合金中Au原子与Cu原子个数之比=1:3,
故答案为:1:3.
点评 本题考查了金属单质及其化合物的综合应用、晶体结构与性质、晶胞计算等知识,题目难度中等,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用能力,注意掌握常见金属单质及其化合物的性质,明确均摊法在晶胞计算中的应用.

 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案| A. | 1:1 | B. | 3:4 | C. | 4:3 | D. | 9:8 |
| A. | 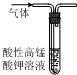 除去CO2中混有的SO2 | B. | 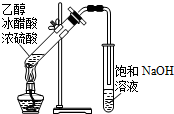 制取较纯净的乙酸乙酯 | ||
| C. | 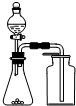 用生石灰和浓氨水制取氨气 | D. | 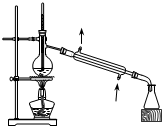 分离苯和四氯化碳的混合物 |
| A. | 熔点:戊烷>2,2一二甲基戊烷>2,3一二甲基丁烷>丙烷 | |
| B. | 密度:CHCl3>H2O>己烷 | |
| C. | 氢元素质量分数:甲烷>乙烷>乙烯>乙炔>苯 | |
| D. | 等质量物质完全燃烧耗O2量:苯>环已烷>已烷 |
| A. | 氧化剂和还原剂的物质的量之比为1:8 | |
| B. | 该过程说明Fe(NO3)2溶液不宜加酸酸化 | |
| C. | 每1 mol NO3-发生氧化反应,转移8 mol 电子 | |
| D. | 若把该反应设计为原电池,则负极反应为Fe2+-e-═Fe3+ |
| A. | 氮气的电子式: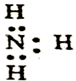 | B. | N2的结构式:N≡N | ||
| C. | 乙酸的结构简式:C2H4O2 | D. | CH4分子的球棍模型: |
| A. | 在动力、设备、材料允许的条件下尽可能在高压下进行 | |
| B. | 温度越高越有利于工业合成氨 | |
| C. | 在工业合成氨中N2、H2的循环利用可提高其利用率,降低成本 | |
| D. | 及时从反应体系中分离出氨气有利于平衡向正反应方向移动 |
 .
.