题目内容
20.现有以下有机物:(用序号回答下列各问)①CH3CHO ②CH3CH2OH ③CH3COOH ④HCOOC2H5
(1)能与NaOH溶液反应的有③④;
(2)能与银氨溶液反应产生银镜的是①④;
(3)既能发生消去反应,又能发生酯化反应的有②;
(4)核磁共振氢谱图中有3个吸收峰,面积比为3:2:1的是②④.
分析 (1)能和NaOH反应的物质中含有羧基或酚羟基或酯基;
(2)能发生银镜反应的物质中含有醛基,可能是醛、甲酸、甲酸某酯等;
(3)能发生消去反应的物质中含有醇羟基或卤原子,且连接醇羟基或卤原子的碳原子相邻碳原子上含有氢原子,能发生酯化反应的物质中含有羟基或羧基;
(4)核磁共振氢谱图中有3个吸收峰,说明含有三类氢原子,面积比为3:2:1的是,说明三类氢原子的个数比为3:2:1.
解答 解:(1)能和NaOH反应的物质中含有羧基或酚羟基或酯基,③中含有羧基、④中含有酯基,所以能和NaOH反应,故选③④;
(2)能发生银镜反应的物质中含有醛基,可能是醛、甲酸、甲酸某酯等,①④中含有醛基,所以能发生银镜反应,故选①④;
(3)能发生消去反应的物质中含有醇羟基或卤原子,且连接醇羟基或卤原子的碳原子相邻碳原子上含有氢原子,能发生酯化反应的物质中含有羟基或羧基,②符合条件,所以能发生消去反应和酯化反应,故选②;
(4)核磁共振氢谱图中有3个吸收峰,说明含有三类氢原子,面积比为3:2:1的是,说明三类氢原子的个数比为3:2:1,②④中含有三类氢原子且氢原子个数比为3:2:1,故选②④.
点评 本题考查有机物结构和性质,为高频考点,把握官能团及其性质关系是解本题关键,注意醇或卤代烃发生消去反应时该物质结构特点,为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
15.有Fe2++H++NO3-→Fe3++NH4++H2O这样一个变化过程,下列叙述不正确的是( )
| A. | 氧化剂和还原剂的物质的量之比为1:8 | |
| B. | 该过程说明Fe(NO3)2溶液不宜加酸酸化 | |
| C. | 每1 mol NO3-发生氧化反应,转移8 mol 电子 | |
| D. | 若把该反应设计为原电池,则负极反应为Fe2+-e-═Fe3+ |
11.(1)请完成该反应的离子方程式:
5C+4 MnO4-+12 H+-5 CO2↑+4 Mn2++6H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中.进行反应CO(g )+H2O(g)?CO2(g)+H2(g)得到如下两组数据:
①实验1从开始到达到化学平衡时,以v(CO2)表示的反应速率为0.13mol/(L•min).(精确到0.01)
②该反应为放(填“吸”或“放”)热反应,实验2中达平衡时 CO的转化率为20%.
(3)在容积可变的密闭容器中发生反应:mA(g)+nB(g)?pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
①当压强从2×105 Pa增加到5×105Pa时,平衡不移动(填:向左,向右,不)
②当压强从5×105 Pa增加到1×106Pa时,该反应平衡常数表达式为K=$\frac{[C]^{p}}{[A]{\;}^{m}}$.(4)在25℃下,向浓度为0.1mol•L-1的FeCl3溶液中逐滴加入氨水,调节溶液pH为 5时,溶液中c(Fe3+)为4×10-11mol/L.(已知25℃时 Ksp[Fe(OH)3]=4×10-38)
5C+4 MnO4-+12 H+-5 CO2↑+4 Mn2++6H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中.进行反应CO(g )+H2O(g)?CO2(g)+H2(g)得到如下两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
②该反应为放(填“吸”或“放”)热反应,实验2中达平衡时 CO的转化率为20%.
(3)在容积可变的密闭容器中发生反应:mA(g)+nB(g)?pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol•L-1 | 0.08 | 0.20 | 0.44 |
②当压强从5×105 Pa增加到1×106Pa时,该反应平衡常数表达式为K=$\frac{[C]^{p}}{[A]{\;}^{m}}$.(4)在25℃下,向浓度为0.1mol•L-1的FeCl3溶液中逐滴加入氨水,调节溶液pH为 5时,溶液中c(Fe3+)为4×10-11mol/L.(已知25℃时 Ksp[Fe(OH)3]=4×10-38)
8.关于工业合成氨的叙述中错误的是( )
| A. | 在动力、设备、材料允许的条件下尽可能在高压下进行 | |
| B. | 温度越高越有利于工业合成氨 | |
| C. | 在工业合成氨中N2、H2的循环利用可提高其利用率,降低成本 | |
| D. | 及时从反应体系中分离出氨气有利于平衡向正反应方向移动 |
15.下列变化过程中,化学键没有被破坏的是( )
| A. | HCl溶于水 | B. | 干冰升华 | ||
| C. | 固体NaCl熔融 | D. | 煤矿中瓦斯(主要成分CH4)遇火爆炸 |
12.下列说法正确的是( )
| A. | 在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量 | |
| B. | 根据原子核外电子排布的特点,Cu属于s区元素 | |
| C. | 因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大 | |
| D. | 核外电子排布由1s22s22p63s1-→1s22s22p6 的变化需要吸收能量 |
9.下列反应符合如图图示的是( )
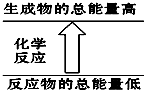

| A. | 铝片与盐酸的反应 | B. | 消石灰与NH4Cl晶体的反应 | ||
| C. | 酸碱中和反应 | D. | 甲烷在氧气中的燃烧反应 |
10.等质量的下列物质分别与足量的盐酸反应,放出二氧化碳气体最多的是( )
| A. | Ca(HCO3)2 | B. | NaHCO3 | C. | Na2CO3 | D. | CaCO3 |