题目内容
4.碳、硅、锗、锡、铅的单质及化合物是 重要的工业材料.(1)金刚石和石墨是碳的两种同素异形体,相同条件下石墨更稳定,则石墨转化为金刚石的反应是吸热(填“放热”或“吸热”)反应.
(2)SiO2在通信领域的一种重要用途是光导纤维.SiO2晶体中的基本结构单元是硅氧四面体.
(3)SnCl2有较强的还原性,写出SnCl2和FeCl3溶液反应的离子方程式2Fe3++Sn2+=2Fe2++Sn4+.
(4)铅丹(Pb3O4)可作为防锈用涂料,呈红褐色.可采用PbS在空气中连续氧化的方法制备:PbS→PbO→Pb3O4,写出第一步氧化的化学方程式2PbS+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2PbO+2SO2.
铅丹曾用于铁制品防锈,请说明它的主要危害重金属(Pb)污染.
1mol铅丹与足量的浓盐酸反应时,转移的电子数目为2NA,写出该反应的化学方程式Pb3O4+8HCl(浓)=3PbCl2+Cl2↑+4H2O.
(5)金属锗、锡在空气中不反应,铅在空气中表面生成一层氧化铅,可能的原因是锗锡铅同主族,铅的金属性最强,可与空气中氧气反应,而锗锡不反应.
分析 (1)相同条件下,物质具有的能量越低越稳定;
(2)二氧化硅晶体可用于制造光导纤维;SiO2晶体中每个Si连接4个O形成四面体结构;
(3)SnCl2和FeCl3发生氧化还原反应生成SnCl4和FeCl2;
(4)PbS在空气中加热生成Pb3O4,根据反应物、生成物及反应条件书写方程式;Pb属于重金属元素;1mol铅丹与足量的浓盐酸反应时,转移的电子数目为2NA,则氧化生成1mol氯气,还生成PbCl2和水;
(5)根据同一主族元素的性质的递变规律分析.
解答 解:(1)相同条件下,物质具有的能量越低越稳定,已知相同条件下石墨更稳定,则石墨具有的能量低于金刚石,则石墨转化为金刚石的反应是吸热反应;
故答案为:吸热;
(2)二氧化硅晶体对光具有全反射的性质,可用于制造光导纤维;SiO2晶体中每个Si连接4个O形成四面体结构,所以SiO2晶体中的基本结构单元是硅氧四面体;
故答案为:光导纤维;硅氧四面体;
(3)SnCl2和FeCl3发生氧化还原反应生成SnCl4和FeCl2,其反应的离子方程式为:2Fe3++Sn2+=2Fe2++Sn4+;
故答案为:2Fe3++Sn2+=2Fe2++Sn4+;
(4)PbS在空气中加热生成Pb3O4和二氧化硫,反应方程式为2PbS+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2PbO+2SO2,Pb属于重金属元素,有毒,会污染环境;1mol铅丹与足量的浓盐酸反应时,转移的电子数目为2NA,则氧化生成1mol氯气,还生成PbCl2和水,则反应的方程式为:Pb3O4+8HCl(浓)=3PbCl2+Cl2↑+4H2O;
故答案为:2PbS+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2PbO+2SO2;重金属(Pb)污染;Pb3O4+8HCl(浓)=3PbCl2+Cl2↑+4H2O;
(5)金属越活泼,在空气中越容易发生反应,同主族自上而下,金属性随着原子序数的增大而增强,铅的原子序数最大,所以铅的金属性比锗和锡都强,故易被空气中的氧气氧化成氧化铅.
故答案为:锗锡铅同主族,铅的金属性最强,可与空气中氧气反应,而锗锡不反应.
点评 本题考查了物质的稳定性与能量的关系、氧化还原反应、元素周期律等知识点,根据方程式书写规则、物质的性质、氧化还原反应等知识点解答,题目难度中等.

 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案| A. | 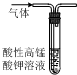 除去CO2中混有的SO2 | B. | 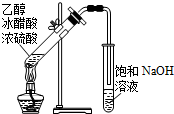 制取较纯净的乙酸乙酯 | ||
| C. | 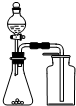 用生石灰和浓氨水制取氨气 | D. |  分离苯和四氯化碳的混合物 |
| A. | 氧化剂和还原剂的物质的量之比为1:8 | |
| B. | 该过程说明Fe(NO3)2溶液不宜加酸酸化 | |
| C. | 每1 mol NO3-发生氧化反应,转移8 mol 电子 | |
| D. | 若把该反应设计为原电池,则负极反应为Fe2+-e-═Fe3+ |
| A. | 氮气的电子式: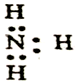 | B. | N2的结构式:N≡N | ||
| C. | 乙酸的结构简式:C2H4O2 | D. | CH4分子的球棍模型: |
| A. | 标准状况下,11.21的己烷所含的分子数为0.5 NA | |
| B. | 28g乙烯所含共用电子对数目为4 NA | |
| C. | 1mol苯乙烯中含有的C=C数为4NA | |
| D. | 2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2NA |
5C+4 MnO4-+12 H+-5 CO2↑+4 Mn2++6H2O
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中.进行反应CO(g )+H2O(g)?CO2(g)+H2(g)得到如下两组数据:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
②该反应为放(填“吸”或“放”)热反应,实验2中达平衡时 CO的转化率为20%.
(3)在容积可变的密闭容器中发生反应:mA(g)+nB(g)?pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol•L-1 | 0.08 | 0.20 | 0.44 |
②当压强从5×105 Pa增加到1×106Pa时,该反应平衡常数表达式为K=$\frac{[C]^{p}}{[A]{\;}^{m}}$.(4)在25℃下,向浓度为0.1mol•L-1的FeCl3溶液中逐滴加入氨水,调节溶液pH为 5时,溶液中c(Fe3+)为4×10-11mol/L.(已知25℃时 Ksp[Fe(OH)3]=4×10-38)
| A. | 在动力、设备、材料允许的条件下尽可能在高压下进行 | |
| B. | 温度越高越有利于工业合成氨 | |
| C. | 在工业合成氨中N2、H2的循环利用可提高其利用率,降低成本 | |
| D. | 及时从反应体系中分离出氨气有利于平衡向正反应方向移动 |
| A. | 铝片与盐酸的反应 | B. | 消石灰与NH4Cl晶体的反应 | ||
| C. | 酸碱中和反应 | D. | 甲烷在氧气中的燃烧反应 |
