题目内容
【题目】氨催化分解既可防治氨气污染,又能得到氢能源,得到广泛研究。
(1)已知:①反应I:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH1=-1266.6 kJ·mol-1
2N2(g)+6H2O(g) ΔH1=-1266.6 kJ·mol-1
②H2(g)+![]() O2(g)=H2O(l) △H2=-285.8 kJ·mol-1
O2(g)=H2O(l) △H2=-285.8 kJ·mol-1
③H2O(l)═H2O(g) ΔH3=+44.0 kJ·mol-1
则反应2NH3(g)![]() N2(g)+3H2(g)的反应热△H=___。
N2(g)+3H2(g)的反应热△H=___。
(2)合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) △H2,在10 L恒容密闭容器中加入4 mol CO和8 mol H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时n(H2)随时间的变化如下表所示:
CH3OH(g) △H2,在10 L恒容密闭容器中加入4 mol CO和8 mol H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时n(H2)随时间的变化如下表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |

①△H2_____(填“>”“<”或“=”)0。
②下列说法正确的是_______(填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
③03min内用CH3OH表示的反应速率v(CH3OH)=___(保留三位小数)。
④200℃时,该反应的平衡常数K=__。向上述200℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,保持温度不变,则化学平衡__(填“正向”、“逆向”或“不”)移动。
(3)体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2![]() 2SO3,并达到平衡,在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率(______________)
2SO3,并达到平衡,在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率(______________)
A. 等于p% B. 大于p% C. 小于p% D. 无法判断
【答案】+92.1 kJ/mol < cd 0.067 mol/(Lmin) 6.25 正向 B
【解析】
(1)根据盖斯定律,将已知的热化学方程式叠加,可得待求反应的热化学方程式;
(2)①温度对平衡的影响因素为温度升高,化学平衡向吸热方向移动,如果正向移动,反应物的转化率会升高;
②a.平衡常数表示反应进行的程度,当平衡正向移动时平衡常数增大;
b.达平衡后再充入稀有气体,压强增大,但不影响反应物和生成物的浓度,平衡不移动;
c.反应CO(g)+2H2(g)![]() CH3OH(g)在进行的过程中,达到平衡前气体总物质的量在不断变化;
CH3OH(g)在进行的过程中,达到平衡前气体总物质的量在不断变化;
d.在恒温恒容的条件下,增大压强,平衡向气体总物质的量减小的方向移动;
③先根据图表计算在03 min内CH3OH的变化浓度,再利用公式v=![]() 计算03 min内v(CH3OH);
计算03 min内v(CH3OH);
④结合平衡状态时各种物质的浓度计算平衡常数K,向上述200℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,保持温度不变,根据此时浓度计算Qc=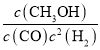 ,再比较Qc与K的关系判断平衡移动方向;
,再比较Qc与K的关系判断平衡移动方向;
(3)甲为恒温恒容,乙为恒温恒压,正反应是气体体积减小的反应,平衡时混合气体物质的量减小,则平衡时甲中压强小于乙中压强,乙中平衡等效为在甲中平衡基础上增大压强,平衡正向移动。
(1)①4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH1=-1266.6 kJ·mol-1
2N2(g)+6H2O(g) ΔH1=-1266.6 kJ·mol-1
②H2(g)+![]() O2(g)=H2O(l) △H2=-285.8 kJ·mol-1
O2(g)=H2O(l) △H2=-285.8 kJ·mol-1
③H2O(l)═H2O(g) ΔH3=+44.0 kJ·mol-1
根据盖斯定律计算[①-(②+③)×6]×![]() ,得到NH3分解为N2和H2的热化学方程式:2NH3(g)
,得到NH3分解为N2和H2的热化学方程式:2NH3(g)![]() N2(g)+3H2(g) △H=+92.1 kJ/mol;
N2(g)+3H2(g) △H=+92.1 kJ/mol;
(2)①由图示可知在恒压条件下,随着温度的升高,CO的转化率降低,说明升高温度平衡逆向移动,逆反应为吸热反应,所以该反应的正反应为放热反应,△H2<0;
②a.反应CO(g)+2H2(g)![]() CH3OH(g)正方向为放热反应,升高温度平衡逆向移动,化学平衡常数减小,a错误;
CH3OH(g)正方向为放热反应,升高温度平衡逆向移动,化学平衡常数减小,a错误;
b.达平衡后再充入稀有气体,压强增大,但由于反应体系中任何一种物质的浓度不变,所以化学平衡不移动,CO的转化率不变,b错误;
c.反应CO(g)+2H2(g)![]() CH3OH(g)在进行的过程中,达到平衡前气体总物质的量在不断变化,当容器内气体压强不再变化时,说明混合气体的总物质的量不再改变,反应达到平衡,即反应达到最大限度,c正确;
CH3OH(g)在进行的过程中,达到平衡前气体总物质的量在不断变化,当容器内气体压强不再变化时,说明混合气体的总物质的量不再改变,反应达到平衡,即反应达到最大限度,c正确;
d.该反应的正反应物是气体体积减小的反应,在恒温恒容的条件下,增大压强,平衡向正方向移动,CO的转化率增大,即图中压强p1<p2,d正确;
故合理选项是cd;
③根据图示可知:在03 min内H2的物质的量变化4.0 mol,则会同时消耗2.0 mol CO,反应产生2.0 mol CH3OH,则v(CH3OH)=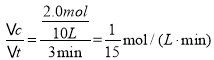 =0.067 mol/(Lmin);
=0.067 mol/(Lmin);
④由③可知反应在3 min时已经达到平衡状态,此时c(H2)=(8.0-4.0)mol÷10 L=0.4 mol/L,c(CO)=0.2 mol/L,c(CH3OH)=0.2 mol/L,则根据平衡常数含义,可得200℃时平衡常数K=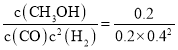 =6.25;向上述200℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,此时各物质的浓度为c(CO)=0.2 mol/L,c(H2)=0.6 mol/L,c(CH3OH)=0.4 mol/L,保持温度不变,则化学平衡不变,此时Qc=
=6.25;向上述200℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,此时各物质的浓度为c(CO)=0.2 mol/L,c(H2)=0.6 mol/L,c(CH3OH)=0.4 mol/L,保持温度不变,则化学平衡不变,此时Qc=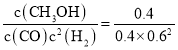 =2.78<6.25=K,则此时平衡应向正反应方向移动;
=2.78<6.25=K,则此时平衡应向正反应方向移动;
(3)甲为恒温恒容,乙为恒温恒压,由于该反应的正反应是气体体积减小的反应,平衡时混合气体物质的量减小,则平衡时甲中压强小于乙中压强,乙中平衡等效为在甲中平衡基础上增大压强,增大压强,化学平衡正向移动,则乙的SO2的转化率将大于甲的SO2的转化率,若甲容器中SO2的转化率为p%,所以乙中容器中SO2的转化率大于P%,故合理选项是B。

 天天向上口算本系列答案
天天向上口算本系列答案