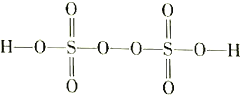
题目内容
【题目】在36g炭不完全燃烧所得气体中CO和CO2的体积比为1:2。已知:
C(s)+1/2O2(g) === CO(g); △H1=-110.35kJ/mol
CO(g)+1/2O2(g) === CO2(g);△H2=-282.57kJ/mol
则与36g炭完全燃烧相比,损失的热量是( )
A.392.93kJB.282.57kJC.784.92kJD.3274.3kJ
【答案】B
【解析】
36g碳的物质的量为![]() =3mol,CO的物质的量为
=3mol,CO的物质的量为![]() ,由CO(g)+1/2O2(g)= CO2(g);△H2=-282.57kJ/mol可知,1molCO燃烧放出的热量为282.57kJ/mol×1mol=282.57kJ,即36g碳不完全燃烧生成1molCO损失的热量为282.57kJ。
,由CO(g)+1/2O2(g)= CO2(g);△H2=-282.57kJ/mol可知,1molCO燃烧放出的热量为282.57kJ/mol×1mol=282.57kJ,即36g碳不完全燃烧生成1molCO损失的热量为282.57kJ。
故选B。

【题目】下列能用勒夏特列原理解释的事实是
A.碳酸钙不溶于水,但溶于盐酸
B.由2NO2(g)N2O4(g) 组成的平衡体系,加压后颜色加深
C.工业上选择常压条件合成SO3
D.选择450℃左右的温度合成氨
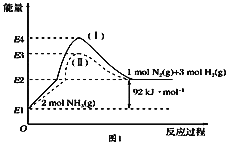
【题目】氨催化分解既可防治氨气污染,又能得到氢能源,得到广泛研究。
(1)已知:①反应I:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH1=-1266.6 kJ·mol-1
2N2(g)+6H2O(g) ΔH1=-1266.6 kJ·mol-1
②H2(g)+![]() O2(g)=H2O(l) △H2=-285.8 kJ·mol-1
O2(g)=H2O(l) △H2=-285.8 kJ·mol-1
③H2O(l)═H2O(g) ΔH3=+44.0 kJ·mol-1
则反应2NH3(g)![]() N2(g)+3H2(g)的反应热△H=___。
N2(g)+3H2(g)的反应热△H=___。
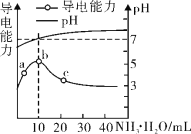
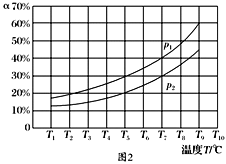
(2)合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) △H2,在10 L恒容密闭容器中加入4 mol CO和8 mol H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时n(H2)随时间的变化如下表所示:
CH3OH(g) △H2,在10 L恒容密闭容器中加入4 mol CO和8 mol H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时n(H2)随时间的变化如下表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |

①△H2_____(填“>”“<”或“=”)0。
②下列说法正确的是_______(填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
③03min内用CH3OH表示的反应速率v(CH3OH)=___(保留三位小数)。
④200℃时,该反应的平衡常数K=__。向上述200℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,保持温度不变,则化学平衡__(填“正向”、“逆向”或“不”)移动。
(3)体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2![]() 2SO3,并达到平衡,在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率(______________)
2SO3,并达到平衡,在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率(______________)
A. 等于p% B. 大于p% C. 小于p% D. 无法判断