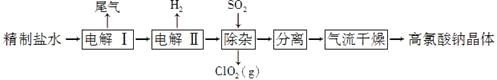
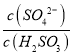题目内容
【题目】(1)已知2molH2完全燃烧生成水蒸气放出热量484kJ,且1molH-H键断裂时吸收热量为436kJ,1molO=O键断裂时吸收热量为496kJ,则水蒸气中1molH-O键形成时放出的热量为_____。
(2)盖斯定律认为:不管化学过程是一步完成或分几步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
已知:H2O(g) === H2O(l) ΔH1= —Q1 kJ/mol
C2H5OH(g) === C2H5OH(l) ΔH2= —Q2 kJ/mol
C2H5OH(g) + 3O2(g) === 2CO2(g) +3H2O(g) ΔH3= —Q3 kJ/mol
若使46g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为____________。
【答案】463kJ (3Q1-Q2+Q3)kJ
【解析】
(1)2mol氢气完全燃烧生成水蒸气时放出热量484kJ,则:2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol,设1molH-O键形成时放出的热量为x kJ,则:484kJ=4×463kJ-(436kJ×2+496 kJ),解得x=463kJ。故1molH-O键形成时放出的热量为463kJ。
(2)①H2O(g) === H2O(l) ΔH1= —Q1 kJ/mol
②C2H5OH(g) === C2H5OH(l) ΔH2= —Q2 kJ/mol
③C2H5OH(g) + 3O2(g) === 2CO2(g) +3H2O(g) ΔH3= —Q3 kJ/mol,
依据盖斯定律,![]() ,可得C2H5OH(l) + 3O2(g) === 2CO2(g) +3H2O(l) ΔH= —(3Q1-Q2+Q3) kJ/mol,46g无水酒精物质的量为
,可得C2H5OH(l) + 3O2(g) === 2CO2(g) +3H2O(l) ΔH= —(3Q1-Q2+Q3) kJ/mol,46g无水酒精物质的量为![]() ,故46g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量(3Q1-Q2+Q3)kJ。
,故46g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量(3Q1-Q2+Q3)kJ。

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案【题目】氨催化分解既可防治氨气污染,又能得到氢能源,得到广泛研究。
(1)已知:①反应I:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH1=-1266.6 kJ·mol-1
2N2(g)+6H2O(g) ΔH1=-1266.6 kJ·mol-1
②H2(g)+![]() O2(g)=H2O(l) △H2=-285.8 kJ·mol-1
O2(g)=H2O(l) △H2=-285.8 kJ·mol-1
③H2O(l)═H2O(g) ΔH3=+44.0 kJ·mol-1
则反应2NH3(g)![]() N2(g)+3H2(g)的反应热△H=___。
N2(g)+3H2(g)的反应热△H=___。
(2)合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) △H2,在10 L恒容密闭容器中加入4 mol CO和8 mol H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时n(H2)随时间的变化如下表所示:
CH3OH(g) △H2,在10 L恒容密闭容器中加入4 mol CO和8 mol H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时n(H2)随时间的变化如下表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |

①△H2_____(填“>”“<”或“=”)0。
②下列说法正确的是_______(填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
③03min内用CH3OH表示的反应速率v(CH3OH)=___(保留三位小数)。
④200℃时,该反应的平衡常数K=__。向上述200℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,保持温度不变,则化学平衡__(填“正向”、“逆向”或“不”)移动。
(3)体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2![]() 2SO3,并达到平衡,在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率(______________)
2SO3,并达到平衡,在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率(______________)
A. 等于p% B. 大于p% C. 小于p% D. 无法判断
【题目】由下列实验及现象推出的相应结论正确的是
选项 | 实验 | 现象 | 结论 |
A | 2 mL0.01mol·L-1的KI溶液中滴入等体积等浓度的FeCl3溶液,将充分反应后的溶液分三份,一份滴入K3[Fe(CN)6]溶液,第二份滴入KSCN溶液,第三份滴入淀粉溶液 | 滴入K3[Fe(CN)6]溶液后产生蓝色沉淀;滴入KSCN溶夜后变血红色;滴入淀粉溶液后溶液变蓝 | KI溶液和FeCl3溶液发生反应:2Fe3++2I- |
B | 向稀硫酸中加入铜片,然后通入氧气加热 | 先无明显现象,通入氧气加热后溶液变蓝 | 氧化性:稀硫酸>Cu2+ |
C | 向浓度均为0.1 mol·L-1的Na2SO3和Na2SiO3溶液中分别滴加酚酞 | Na2SiO3溶液红色更深 | 非金属性:Si<S |
D | 将几滴等浓度的FeCl3溶液、AlCl3溶液同时滴入足量等浓度的NaOH溶液中 | 只产生红褐色沉淀 | Ksp[Al(OH)3]>K sp[Fe(OH)3] |
A. A B. B C. C D. D