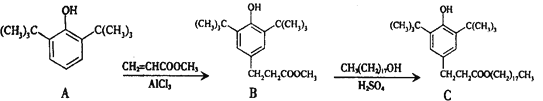
题目内容
【题目】石墨烯是只由一层碳原子所构成的平面薄膜,其结构模型见如图。有关说法错误的是( )

A.晶体中碳原子键全部是碳碳单键
B.石墨烯与金刚石都是碳的同素异形体
C.石墨烯中所有碳原子可以处于同一个平面
D.从石墨中剥离得到石墨烯需克服分子间作用力
【答案】A
【解析】
A. 石墨烯内部碳原子的排列方式与石墨单原子层一样,以sp2杂化轨道成键,每个碳原子中的三个电子与周围的三个碳原子形成三个σ键以外,余下的一个电子与其它原子的电子之间形成离域大π键,故A错误;
B. 石墨烯和金刚石都是碳元素的不同单质,属于同素异形体,故B正确;
C. 石墨烯中的碳原子采取sp2杂化,形成了平面六元并环结构,所有碳原子处于同一个平面,故C正确;
D. 石墨结构中,石墨层与层之间存在分子间作用力,所以从石墨中剥离得到石墨烯需克服石墨层与层之间的分子间作用力,故D正确;
答案选A。

【题目】氨催化分解既可防治氨气污染,又能得到氢能源,得到广泛研究。
(1)已知:①反应I:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH1=-1266.6 kJ·mol-1
2N2(g)+6H2O(g) ΔH1=-1266.6 kJ·mol-1
②H2(g)+![]() O2(g)=H2O(l) △H2=-285.8 kJ·mol-1
O2(g)=H2O(l) △H2=-285.8 kJ·mol-1
③H2O(l)═H2O(g) ΔH3=+44.0 kJ·mol-1
则反应2NH3(g)![]() N2(g)+3H2(g)的反应热△H=___。
N2(g)+3H2(g)的反应热△H=___。
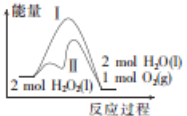
(2)合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) △H2,在10 L恒容密闭容器中加入4 mol CO和8 mol H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时n(H2)随时间的变化如下表所示:
CH3OH(g) △H2,在10 L恒容密闭容器中加入4 mol CO和8 mol H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时n(H2)随时间的变化如下表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |

①△H2_____(填“>”“<”或“=”)0。
②下列说法正确的是_______(填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
③03min内用CH3OH表示的反应速率v(CH3OH)=___(保留三位小数)。
④200℃时,该反应的平衡常数K=__。向上述200℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,保持温度不变,则化学平衡__(填“正向”、“逆向”或“不”)移动。
(3)体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2![]() 2SO3,并达到平衡,在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率(______________)
2SO3,并达到平衡,在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率(______________)
A. 等于p% B. 大于p% C. 小于p% D. 无法判断
【题目】下表是四种盐在不同温度下的溶解度(g/100g水):(假设:盐类共存时不影响各自的溶解度,分离晶体时,溶剂的损耗忽略不计)
NaNO3 | KNO3 | NaCl | KCl | |
10℃ | 80.5 | 21.2 | 35.7 | 31.0 |
100℃ | 175 | 246 | 39.1 | 56.6 |
用物质的量之比为1:1的硝酸钠和氯化钾为原料,制取硝酸钾晶体,其流程如图所示
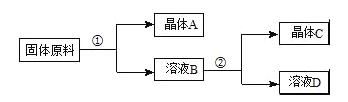
以下说法错误的是( )
A.①和②的实验过程中,都需要控制温度
B.①实验操作依次为:加水溶解、蒸发浓缩结晶、趁热过滤
C.②实验操作依次为:加水溶解、蒸发浓缩结晶、趁热过滤
D.用95%的酒精洗涤所得的硝酸钾晶体比较好
【题目】由下列实验及现象推出的相应结论正确的是
选项 | 实验 | 现象 | 结论 |
A | 2 mL0.01mol·L-1的KI溶液中滴入等体积等浓度的FeCl3溶液,将充分反应后的溶液分三份,一份滴入K3[Fe(CN)6]溶液,第二份滴入KSCN溶液,第三份滴入淀粉溶液 | 滴入K3[Fe(CN)6]溶液后产生蓝色沉淀;滴入KSCN溶夜后变血红色;滴入淀粉溶液后溶液变蓝 | KI溶液和FeCl3溶液发生反应:2Fe3++2I- |
B | 向稀硫酸中加入铜片,然后通入氧气加热 | 先无明显现象,通入氧气加热后溶液变蓝 | 氧化性:稀硫酸>Cu2+ |
C | 向浓度均为0.1 mol·L-1的Na2SO3和Na2SiO3溶液中分别滴加酚酞 | Na2SiO3溶液红色更深 | 非金属性:Si<S |
D | 将几滴等浓度的FeCl3溶液、AlCl3溶液同时滴入足量等浓度的NaOH溶液中 | 只产生红褐色沉淀 | Ksp[Al(OH)3]>K sp[Fe(OH)3] |
A. A B. B C. C D. D