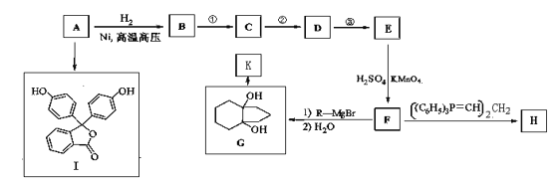
��Ŀ����
����Ŀ���ڲ��������У���¯��ԭ�Ϸ�������Ҫ��ӦΪ��2Na2CO3+CaCO3+3SiO2![]() 2Na2SiO3+CaSiO3+CO2��
2Na2SiO3+CaSiO3+CO2��
��1��ij��Ӧ��������״̬�²����磬������___���塣
��2��������Ӧ�����漰�Ķ�����Ԫ��ԭ�Ӱ뾶�ɴ�С��˳��Ϊ___��
��3��̼������ͬ��Ԫ�أ�����Ԫ�ص�ԭ�����������ʾʽΪ___��
��4��дһ���ܱȽ�̼Ԫ�غ���Ԫ�طǽ�����ǿ���Ļ�ѧ��Ӧ����ʽ��___��
��5��CO2�ĵ���ʽΪ___��
��6����Ӧ��Na2CO3��CaCO3�����Ʊ�������̼�������������Ƕ���ʹ��ϡ���ᣬ��˵�����ɣ�___��
���𰸡�ԭ�� Na>Si>C>O 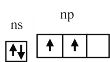 C+O2
C+O2 CO2
CO2 ![]() ̼�����Ƿ�ĩ״���壬��ϡ���ᷴӦ�ٶ�̫�죬���Կ��ƣ�̼�����ϡ���ᷴӦ����������ˮ������ƣ������ڷ�Ӧ�������ֹ��Ӧ�Ľ�һ������
̼�����Ƿ�ĩ״���壬��ϡ���ᷴӦ�ٶ�̫�죬���Կ��ƣ�̼�����ϡ���ᷴӦ����������ˮ������ƣ������ڷ�Ӧ�������ֹ��Ӧ�Ľ�һ������
��������
��1����Ӧ����SiO2������״̬�²����磬����ԭ�Ӿ��壻
��2���漰�Ķ�����Ԫ����Na��C��O��Si��һ����Ӳ�Խ��ԭ�Ӱ뾶Խ��ͬ���ڵ��Ӳ���ͬ��������ԭ�Ӱ뾶���μ�С������Na��C��Si��Oԭ�Ӱ뾶�ɴ�С��˳��Ϊ��Na��Si��C��O��
��3��C��SiΪ����A��Ԫ�أ�����������Ϊ4��s�ܼ�2�����ӣ�p�ܼ�2�����ӣ����������ʾʽΪ ��
��
��4���ǽ�������������Խǿ��Ԫ�طǽ�����Խǿ��C+O2 CO2����Ӧ������Ϊ��������̼Ϊ��ԭ������������������̼������֤�����ǽ�����ǿ��̼��
CO2����Ӧ������Ϊ��������̼Ϊ��ԭ������������������̼������֤�����ǽ�����ǿ��̼��
��5��CO2�ǹ��ۻ������ṹʽΪO=C=O��̼ԭ�Ӻ���ԭ��֮����2�Ե��ӣ������ʽΪ![]() ��
��
��6������������̼���Ʒ�Ӧ��ȡ������̼ԭ��̼�����Ƿ�ĩ״���壬��ϡ���ᷴӦ�ٶ�̫�죬���Կ��ƣ�����������̼��Ʒ�Ӧ��ȡ������̼ԭ��̼��������ᷴӦ�������������ḽ�������ɵIJ��ֳ������棬��ֹ��Ӧ��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��25��ʱ���������ʵĵ���ƽ�ⳣ�������ʾ��
��ѧʽ | CH3COOH | H2CO3 | HClO |
����ƽ�ⳣ�� | 1.7��10��5molL��1 | K1=4.4��10��7molL��1 K2=5.6��10��11molL��1 | 3.0��10��8molL��1 |
��ش��������⣺
��1��ͬŨ�ȵ�CH3COO����HCO3����CO32����ClO�����H+��������ǿ������˳��Ϊ________��
��2��������0.1molL��1��CH3COOH��Һ�ڼ�ˮϡ�����У����б���ʽ������һ����С����________������ĸ��ţ���ͬ����
A��c��H+�� B��c(H+)/c(CH3COOH) C��c��H+��c��OH���� D��c(OH-)/ c��H+�� E��c(H+)c(CH3COO-)/ c(CH3COOH)
������Һ�����¶ȣ�����5�ֱ���ʽ�������������________��
��3�����Ϊ10mL pH=2�Ĵ�����Һ��һԪ��HX��Һ�ֱ��ˮϡ����1000mL��ϡ����pH�仯��ͼ��

��HX�ĵ���ƽ�ⳣ��________��������������������������С�����������ƽ�ⳣ����ϡ�ͺ�HX��Һ����ˮ���������c��H+��________��������������������������С�������������Һ����ˮ���������c��H+����������____________________��
��4����֪100��ʱ��ˮ�����ӻ�Ϊ1��10��12�� ���¶��²��ij��ҺpH=7������Һ��________�����������������������������ԣ������¶���pH=1��H2SO4��ҺaL��pH=11��NaOH��ҺbL��ϣ������û��ҺpH=2����a��b=________��
����Ŀ�������ֽ�ȿɷ��ΰ�����Ⱦ�����ܵõ�����Դ���õ��㷺�о���
(1)��֪���ٷ�ӦI��4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ��H1=-1266.6 kJ��mol-1
2N2(g)+6H2O(g) ��H1=-1266.6 kJ��mol-1
��H2(g)+![]() O2(g)=H2O(l) ��H2=-285.8 kJ��mol-1
O2(g)=H2O(l) ��H2=-285.8 kJ��mol-1
��H2O(l)�TH2O(g) ��H3=+44.0 kJ��mol-1
��Ӧ2NH3(g)![]() N2(g)+3H2(g)�ķ�Ӧ����H=___��
N2(g)+3H2(g)�ķ�Ӧ����H=___��
(2)�ϳɼ״��ķ�ӦΪ��CO(g)+2H2(g)![]() CH3OH(g) ��H2����10 L�����ܱ������м���4 mol CO��8 mol H2�����CO��ƽ��ת�������¶Ⱥ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��200��ʱn(H2)��ʱ��ı仯���±���ʾ��
CH3OH(g) ��H2����10 L�����ܱ������м���4 mol CO��8 mol H2�����CO��ƽ��ת�������¶Ⱥ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��200��ʱn(H2)��ʱ��ı仯���±���ʾ��
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |

�١�H2_____(���������������)0��
������˵����ȷ����_______(���ţ���
a.�¶�Խ�ߣ��÷�Ӧ��ƽ�ⳣ��Խ��
b.��ƽ����ٳ���ϡ�����壬CO��ת�������
c.����������ѹǿ���ٱ仯ʱ����Ӧ�ﵽ�����
d.ͼ��ѹǿp1<p2
��03min����CH3OH��ʾ�ķ�Ӧ����v(CH3OH)=___(������λС��)��
��200��ʱ���÷�Ӧ��ƽ�ⳣ��K=__��������200��ﵽƽ��ĺ����ܱ��������ټ���2 mol CO��2 mol H2��2 mol CH3OH�������¶Ȳ��䣬��ѧƽ��__(�������������)�ƶ���
(3)�����ͬ�ļס������������У��ֱ��е����ʵ�����SO2��O2������ͬ�¶��·�����Ӧ��2SO2+O2![]() 2SO3�����ﵽƽ�⣬��������У�����������������䣬����������ѹǿ���䣬����������SO2��ת����Ϊp%������������SO2��ת������______________��
2SO3�����ﵽƽ�⣬��������У�����������������䣬����������ѹǿ���䣬����������SO2��ת����Ϊp%������������SO2��ת������______________��
A. ����p% B. ����p% C. С��p% D. ���ж�