题目内容
【题目】氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯是一种准晶体,该晶体是一种无平移周期序,但有严格准周期位置序的独特晶体。可通过___方法区分晶体、准晶体和非晶体。
(2)K元素的基态原子的电子填充于___个不同的能级。
(3)[H2F]+[SbF6]-(氟酸锑)是一种超强酸,存在[H2F]+,该离子的空间构型为___,写出一种与[H2F]+具有相同空间构型和键合形式的阴离子是___。
(4)NH4F(氟化铵)可作为玻璃蚀刻剂、防腐剂、消毒剂等。NH4+的中心原子的杂化类型是___;氟化铵中存在___(填字母)。
A.离子键 B.σ键 C.π键 D.氢键
(5)SbF6被广泛用作高压电气设备绝缘介质。SbF6是一种共价化合物,可通过类似BornHaber循环能量构建能量图(见图a)计算相关键能。则F—F键的键能为___kJ·mol-1,S—F的键能为___kJ·mol-1。
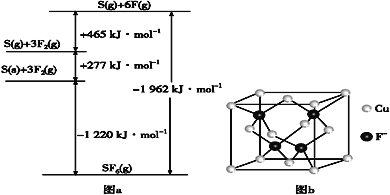
(6)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃,密度为7.1g·cm-3。
①CuF比CuCl熔点高的原因是___;
②已知NA为阿伏加德罗常数的值。CuF的晶胞结构如“图b”。则CuF的晶胞参数a=___nm(列出计算式)。
【答案】X-射线衍射实验 6 V形 NH2- sp3 AB 155 327 CuCl为分子晶体,CuF为离子晶体 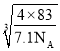 ×107
×107
【解析】
(1)晶体对X射线发生衍射,非晶体不发生衍射,准晶体介于二者之间。聚四氟乙烯是一种准晶体,该晶体是一种无平移周期序,但有严格准周期位置序的独特晶体。可通过X-射线衍射实验方法区分晶体、准晶体和非晶体。故答案为:X-射线衍射实验;
(2)K元素的基态原子的电子填充于1s、2s、2p、3s、3p、4s,6个不同的能级。故答案为:6;
(3)[H2F]+[SbF6]-(氟酸锑)是一种超强酸,存在[H2F]+,[H2F]+与H2O、NH2-等互为等电子体,结构相似,该离子的空间构型为V形,与[H2F]+具有相同空间构型和键合形式的阴离子是NH2-。故答案为:V形; NH2-;
(4)NH4+的中心原子N原子形成4个σ键,杂化类型是sp3;氟化铵为离子化合物,含有离子键和共价键,即σ键。
故答案为:sp3 ;AB;
(5)由图象可知,断裂3molF-F键,吸收465kJ能量,则F-F键的键能为155kJ·mol-1,形成6molS-F键,放出1962kJ能量,则S-F的键能为![]() kJ·mol-1=327kJ·mol-1,
kJ·mol-1=327kJ·mol-1,
故答案为:155;327;
(6)①CuCl的熔点为426℃,熔化时几乎不导电,属于分子晶体;CuF的熔点为908℃,熔点比CuCl高,是离子晶体。CuF比CuCl熔点高的原因是CuCl为分子晶体,CuF为离子晶体;
故答案为:CuCl为分子晶体,CuF为离子晶体;
②如“图b”,CuF的密度为7.1g·cm-3,晶胞中Cu、F的个数分别为4,(其中Cu为8×![]() +6×
+6×![]() =4),则
=4),则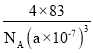 =7.1g·cm-3,则CuF的晶胞参数a=
=7.1g·cm-3,则CuF的晶胞参数a=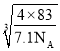 ×107nm。
×107nm。
故答案为: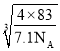 ×107。
×107。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案【题目】某兴趣小组研究亚硝酸钠,查阅下列资料,试根据信息回答下列问题
药品 | NaNO2(亚硝酸钠) |
性质 | 1.在酸性溶液中有较强氧化性,能将Fe2+氧化成Fe3+; 2.AgNO2是一种难溶于水、易溶于酸的盐 |
(1)已知NaNO2能发生如下反应:2NaNO2 + 4HI = 2NO↑+ I2+ 2NaI + 2H2O
请用双线桥表示电子转移的方向和数目____________。该反应中氧化产物是_____________(填化学式);若有2molHI被氧化,则被还原的氧化剂粒子数是________________。
(2)误食NaNO2会导致血红蛋白中的Fe2+转化成Fe3+而中毒,可服用维生素C解毒。下列分析正确的是_____(填序号)
A. NaNO2被还原
B. 维生素C具有氧化性
C.还原性:Fe2+>维生素C
D. NaNO2是还原剂
(3)下列方法中,不能用来区分NaNO2和NaCl的是_________________(填序号)
A. 在酸性条件下加入KI淀粉溶液
B. 分别滴加酸化FeSO4溶液和KSCN溶液
C.焰色反应
D. 分别滴加AgNO3溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式_________________________________________________。