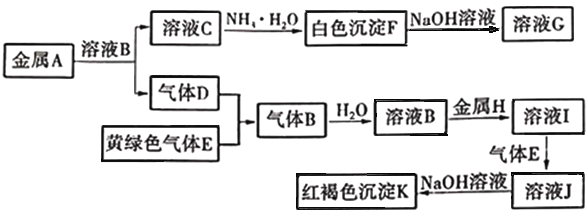
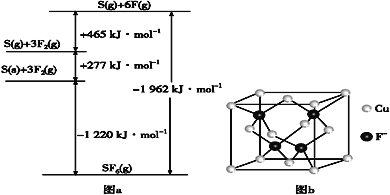
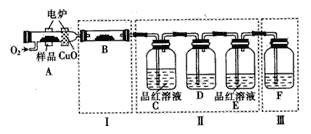
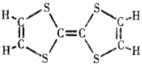
题目内容
【题目】按要求填空。
(1)根据反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,氧化剂与还原剂的物质的量之比是_____,当有2molHNO3参加反应时,被氧化的物质是____g,电子转移数目约为_____个。
(2)在反应K2S+4H2SO4(浓)![]() K2SO4+4SO2↑+4H2O中,氧化产物是____,还原产物是______,氧化剂与还原剂物质的量之比是_____。
K2SO4+4SO2↑+4H2O中,氧化产物是____,还原产物是______,氧化剂与还原剂物质的量之比是_____。
(3)某同学写出以下三个化学方程式:(未配平)
①NO+HNO3→N2O3+H2O
②NH3+NO→HNO2+H2O
③N2O4+H2O→HNO3+HNO2
其中你认为不可能实现的是______。
(4)今有下列三个氧化还原反应:
①2FeCl3+2KI=2FeCl2+2KCl+I2
②2FeCl2+Cl2=2FeCl3
③2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
氧化性最强的物质的是____(填字母,下同),若某溶液中有Fe2+、I-、Cl-共存,要将I-氧化除去而不氧化Fe2+和Cl-,则可加入的试剂是____。
A.Cl2 B.KMnO4 C.FeCl3 D.I2
(5)30mL浓度为0.05mol·L-1的Na2SO3溶液恰好与25mL浓度为0.02mol·L-1的K2R2O7溶液反应,则元素R在还原产物中的化合价是_______。
【答案】2∶1 32 6.02×1023 SO2 SO2 3∶1 ② B C +3
【解析】
(1)反应方程式Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O中化合价变化为:Cu→Cu(NO3)2,Cu元素由0价→+2价,所以Cu是还原剂,HNO3→NO2,N元素由+5价→+4价,所以HNO3为氧化剂,但反应中只有一半的HNO3作氧化剂,因此由反应方程式可知氧化剂与还原剂的物质的量之比等于化学计量数之比为2∶1;当有2molHNO3参加反应时,被氧化的物质是Cu,其质量为2mol×![]() ×64g/mol=32g;电子转移数目约为2mol×
×64g/mol=32g;电子转移数目约为2mol×![]() ×(2-0)×6.02×1023/mol=6.02×1023,故答案为:2∶1,32,6.02×1023。
×(2-0)×6.02×1023/mol=6.02×1023,故答案为:2∶1,32,6.02×1023。
(2)反应K2S+4H2SO4(浓)![]() K2SO4+4SO2↑+4H2O中,只有S元素的化合价发生变化,K2S中S元素为-2价,H2SO4中S为+6价,SO2中S为+4价,所以K2S中S从-2价升高到+4价,H2SO4中S从+6降低到+4价,因此SO2既是氧化产物,又是还原产物;氧化剂是H2SO4,还原剂是K2S,参加反应的4分子硫酸中,有1分子表现酸性,生成硫酸钾,有3分子表现氧化性,因此氧化剂与还原剂的物质的量之比为3:1,故答案为:SO2,SO2,3∶1。
K2SO4+4SO2↑+4H2O中,只有S元素的化合价发生变化,K2S中S元素为-2价,H2SO4中S为+6价,SO2中S为+4价,所以K2S中S从-2价升高到+4价,H2SO4中S从+6降低到+4价,因此SO2既是氧化产物,又是还原产物;氧化剂是H2SO4,还原剂是K2S,参加反应的4分子硫酸中,有1分子表现酸性,生成硫酸钾,有3分子表现氧化性,因此氧化剂与还原剂的物质的量之比为3:1,故答案为:SO2,SO2,3∶1。
(3)氧化还原反应中元素化合价有升必有降。①中,NO、HNO3中氮的化合价分别为+2价、+5价,生成N2O3(氮的化合价为+3价)的过程中氮元素的化合价有升有降,此反应可能实现;②中,NH3、NO中氮的化合价分别为-3价、+2价,生成HNO2(氮的化合价为+3价)的过程中氮元素的化合价都是升高,此反应不可能实现;③中,N2O4(氮的化合价为+4价)生成HNO3(氮的化合价为+5价)、HNO2(氮的化合价为+3价)的过程中氮元素的化合价有升有降,此反应可能实现,故答案为:②。
(4)由反应①知氧化性Fe3+>I2,还原性I->Fe2+;由反应②知氧化性Cl2>Fe3+,还原性Fe2+>Cl-;由反应③知氧化性MnO4->Cl2,还原性Cl->Mn2+。由此推知:氧化性强弱顺序为MnO4->Cl2>Fe3+>I2,还原性强弱顺序为Mn2+<Cl-<Fe2+<I-。所以KMnO4可氧化Cl-、Fe2+和I-,Cl2可氧化Fe2+和I-,FeCl3只能氧化I-。所以只能选FeCl3氧化I-而使Cl-不被氧化,故答案为:B,C。
(5)n(Na2SO3)=0.05mol·L-1×0.03L=0.0015mol,n(K2R2O7)=0.02mol·L-1×0.025L=0.005mol,K2R2O7和Na2SO3发生氧化还原反应生成Na2SO4,设R元素在还原产物中的化合价为x,根据转移电子守恒得0.0015mol×(6-4)=0.0005mol×2×(6-x),解得x=3,故答案为:+3。

【题目】下列各组物质中,满足图中所示物质转化关系且经过一步就能实现的是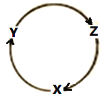
选项 | X | Y | Z |
A | Na | NaOH | Na2O2 |
B | Fe | FeCl2 | Fe(OH)3 |
C | NO | NO2 | HNO3 |
D | Al | Al2O3 | Al(OH)3 |
A.AB.BC.CD.D
【题目】两份体积相同的某植物营养液,其配方分别如下:
KCl | K2SO4 | ZnSO4 | |
① | 0.3 mol·L-1 | 0.2 mol·L-1 | 0.1 mol·L-1 |
② | 0.1 mol·L-1 | 0.3 mol·L-1 | — |
下列对这两份营养液成分的分析中正确的是( )
A. K+的物质的量相同
B. Cl-的物质的量相同
C. 完全相同
D. SO![]() 的物质的量不同
的物质的量不同