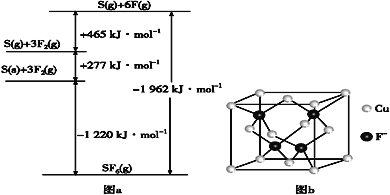
题目内容
【题目】I.下列物质:①氢氧化钠溶液、②铝片、③液态HCl 、④葡萄糖、⑤熔融的NaCl、⑥SO2 气体、⑦碳酸氢钠、 ⑧氧化铝
(1)属于电解质的是______________________。(填编号)
(2)能导电的是____________________________________。(填编号)
(3)①和②反应的离子方程式________________________________。
II.实验室可通过K2Cr2O7溶液测定补铁剂中FeSO4的含量,反应如下K2Cr2O7 +□FeSO4 +□H2SO4 =□Cr2(SO4)3+□Fe2(SO4)3+□K2SO4+□H2O
(1)配平上述方程式,并在方程式上面用“双线桥”标明电子转移的方向和数目。_______________
(2)该反应的还原产物为__________。若反应中消耗1 mol K2Cr2O7,则转移电子数为______。
【答案】③⑤⑦⑧ ①②⑤ 2Al+2OH-+2H2O=2AlO2-+3H2↑ 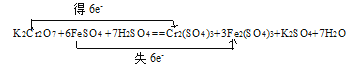 Cr2(SO4)3 6NA
Cr2(SO4)3 6NA
【解析】
(1)根据电解质和非电解质的概念进行判断;
(2)导电的原理是溶液中存在着自由移动的离子,或者金属中自由电子的定向移动;
(3)根据铝片和氢氧化钠溶液反应的原理进行书写;
II.(1)根据氧化还原反应中得失电子守恒的原则进行氧化剂和还原剂的配平,根据原子守恒进行判断。
(1)电解质是指在水溶液或熔化状态下能导电的化合物,所以③液态HCl、⑤熔融的NaCl、⑦碳酸氢钠、⑧氧化铝符合概念,属于电解质;答案:③⑤⑦⑧。
(2)导电的物质有电解质溶液或是融化状态下的电解质,还有金属,符合条件的为:①氢氧化钠溶液、②铝片、⑤熔融的NaCl;所以答案:①②⑤;
(3)①氢氧化钠溶液、②铝片,①和②反应生成偏铝酸钠和氢气,其离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑ ;答案:2Al+2OH-+2H2O=2AlO2-+3H2↑。
II. (1)K2Cr2O7![]() Cr2(SO4)3转移的电子数为:6e-;2 FeSO4
Cr2(SO4)3转移的电子数为:6e-;2 FeSO4![]() Fe2(SO4)3转移的电子数为:2e-,根据得失电子守恒在Fe2(SO4)3前加系数3,FeSO4前加系数6,K2Cr2O7前加系数1,Cr2(SO4)3前加系数1;再根据原子守恒K2SO4前加系数1,H2SO4前加系数7,H2O前加系数7,用双线桥法表示为
Fe2(SO4)3转移的电子数为:2e-,根据得失电子守恒在Fe2(SO4)3前加系数3,FeSO4前加系数6,K2Cr2O7前加系数1,Cr2(SO4)3前加系数1;再根据原子守恒K2SO4前加系数1,H2SO4前加系数7,H2O前加系数7,用双线桥法表示为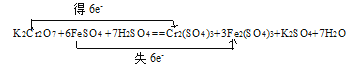 ,答案:
,答案: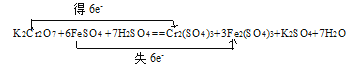
(2)根据反应方程式K2Cr2O7 +6FeSO4 +7H2SO4 =Cr2(SO4)3+3Fe2(SO4)3+K2SO4+7H2O可知,该反应的还原产物为Cr2(SO4)3。若反应中消耗1 mol K2Cr2O7,则转移电子数为6NA;答案:Cr2(SO4)3 ;6NA。

【题目】如表是元素周期表的一部分,根据表中给出的10种元素,按要求作答。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | N | O | F | Ne | ||||
3 | Na | Mg | Al | Si | S | Cl |
(1)金属性最强的元素是_______;
(2)F的原子结构示意图是________;
(3)地壳中含量最多的元素是_______;
(4)Ne原子的最外层电子数是_______;
(5)N与O原子半径较大的是_______;
(6)H2S与HCl热稳定性较弱的是______;
(7)Na2O与MgO难与水反应的是______;
(8)Mg(OH)2与Al(OH)3能与强碱反应的是______;
(9)用于制造光导纤维的物质是______(填“Si”或“SiO2”);
(10)次氯酸(HClO)具有杀菌漂白作用,其中Cl元素的化合价为____,HClO不稳定,易分解生成HCl和O2,写出其在光照条件下分解的化学方程式:____。
【题目】一定温度(t℃)下,向1 L密闭容器中通入H2和 I2各0.15 mol,发生如下反应: H2(g) + I2(g) ![]() 2HI(g),ΔH<0 一段时间后达到平衡,测得数据如下:
2HI(g),ΔH<0 一段时间后达到平衡,测得数据如下:
t/min | 2 | 4 | 7 | 9 |
n(I2)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
请回答:
(1)反应到第___________分钟达到平衡状态。
(2)2 min内,v(H2) =______________mol/(L·min)。
(3)下列能证明该反应已经达到平衡的是________(填字母)。
a. v正(H2)= v逆 (HI) b. 混合气体的颜色不再发生变化
c. 混合气体中各组分的物质的量不再发生变化 d. 混合气体的密度不再变化。
(4)①该反应的化学平衡常数表达式为_______________。②H2的平衡转化率是__________________。
(5)升高温度,化学平衡常数K要___________(填“变大”或“变小”)。
(6)该温度(t℃)下,若开始通入一定量的H2和 I2,反应达到平衡时,测得c(H2)=0.4mol/L,c(I2)=0.9mol/L,则平衡时c(HI)=______________mol/L.