��Ŀ����
����Ŀ��ij��ȤС���о���������,������������,�Ը�����Ϣ�ش���������
ҩƷ | NaNO2���������ƣ� |
���� | 1.��������Һ���н�ǿ�����ԣ��ܽ�Fe2��������Fe3���� 2.AgNO2��һ��������ˮ������������� |
(1)��֪NaNO2�ܷ������·�Ӧ��2NaNO2 + 4HI = 2NO��+ I2+ 2NaI + 2H2O
����˫���ű�ʾ����ת�Ƶķ������Ŀ____________���÷�Ӧ������������_____________���ѧʽ��������2molHI����������ԭ����������������________________��
(2)��ʳNaNO2�ᵼ��Ѫ�쵰���е�Fe2��ת����Fe3�����ж����ɷ���ά����C�ⶾ�����з�����ȷ����_____������ţ�
A. NaNO2����ԭ
B. ����C����������
C.��ԭ�ԣ�Fe2����ά����C
D. NaNO2�ǻ�ԭ��
(3)���з����У�������������NaNO2��NaCl����_________________������ţ�
A. �����������¼���KI������Һ
B. �ֱ�μ��ữFeSO4��Һ��KSCN��Һ
C.��ɫ��Ӧ
D. �ֱ�μ�AgNO3��Һ
(4)ijͬѧ�����Ƶ���ˮ�ӵ�NaNO2��Һ�У��۲쵽��ˮ��ɫ��ͬʱ����NaNO3��HCl����д����Ӧ�����ӷ���ʽ_________________________________________________��
���𰸡�)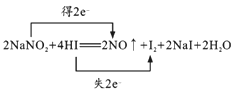 I2 2NA A CD NO2-+Cl2+H2O=NO3-+2H++2Cl-
I2 2NA A CD NO2-+Cl2+H2O=NO3-+2H++2Cl-
��������
��1��2NaNO2+4HI��2NO��+I2+2NaI+2H2O�У�NԪ�صĻ��ϼ۽��͡�IԪ�صĻ��ϼ����ߣ��÷�Ӧת��2e����
��2��NaNO2�ᵼ��Ѫ�쵰���е�Fe2+ת��ΪFe3+��NaNO2���������ԣ�����ά����C �ⶾ����֪ά����C���л�ԭ�ԣ�
��3��NaNO2��NaCl ����������ͬ�������Ӳ�ͬ�����2NaNO2+4HI��2NO��+I2+2NaI+2H2O����������KSCN��ҺΪѪ��ɫ����
��4����ˮ�ӵ�NaNO2��Һ�У��۲쵽��ˮ��ɫ��ͬʱ����NaNO3��HCl��ClԪ�صĻ��ϼ۽��͡�NԪ�صĻ��ϼ����ߡ�
��1��2NaNO2+4HI��2NO��+I2+2NaI+2H2O�У�IԪ�صĻ��ϼ����ߣ�����������ΪI2���ɷ�Ӧ��֪2molHI����������������������Ϊ2NA��NԪ�صĻ��ϼ۽��͡�IԪ�صĻ��ϼ����ߣ��÷�Ӧת��2e������˫���ű�ʾ����ת�Ƶķ������ĿΪ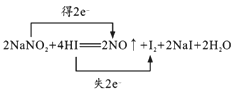 ��
��
�ʴ�Ϊ�� ��I2��2NA��
��I2��2NA��
��2��A��NԪ�صĻ��ϼ۽��ͣ���NaNO2����ԭ����A��ȷ��
B��ά����C�ⶾʱ��FeԪ�صĻ��ϼ۽��ͣ���ά����C���л�ԭ�ԣ���B����
C�����ѡ��B��֪��ԭ�ԣ�ά����C��Fe2+����C����
D��NaNO2������������D����
�ʴ�Ϊ��A��
��3��A�������������¼���KI ������Һ���������岢����Һ������ΪNaNO2���������ΪNaCl���ɼ��𣬹�A���������⣻
B���ֱ�μ��ữFeSO4��Һ��KSCN ��Һ������Ѫ��ɫ��ΪNaNO2���������ΪNaCl���ɼ��𣬹�B���������⣻
C����ɫ��Ӧ��Ϊ��ɫ�����ܼ��𣬹�C�������⣻
D���ֱ�μ�AgNO3��Һ�������ɰ�ɫ���������ܼ��𣬹�D�������⣻
�ʴ�Ϊ��CD��
��4����ˮ�ӵ�NaNO2��Һ�У��۲쵽��ˮ��ɫ��ͬʱ����NaNO3��HCl��ClԪ�صĻ��ϼ۽��͡�NԪ�صĻ��ϼ����ߣ��ɵ��ӡ���ɼ�ԭ���غ��֪���ӷ�ӦΪNO2��+Cl2+H2O��NO3��+2H++2Cl�����ʴ�Ϊ��NO2��+Cl2+H2O��NO3��+2H++2Cl����

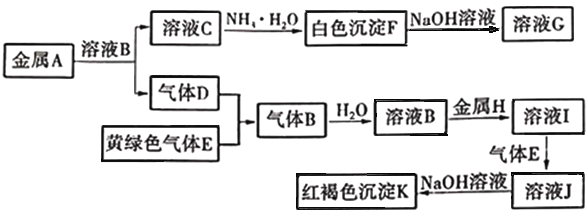
����Ŀ�����и��������У�����ͼ����ʾ����ת����ϵ�Ҿ���һ������ʵ�ֵ���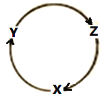
ѡ�� | X | Y | Z |
A | Na | NaOH | Na2O2 |
B | Fe | FeCl2 | Fe(OH)3 |
C | NO | NO2 | HNO3 |
D | Al | Al2O3 | Al(OH)3 |
A.AB.BC.CD.D
����Ŀ�������Ԫ�����ڱ���һ���֣����ݱ��и�����10��Ԫ�أ���Ҫ������
������ ���ڡ��� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
2 | N | O | F | Ne | ||||
3 | Na | Mg | Al | Si | S | Cl |
��1����������ǿ��Ԫ����_______��
��2��F��ԭ�ӽṹʾ��ͼ��________��
��3���ؿ��к�������Ԫ����_______��
��4��Neԭ�ӵ�������������_______��
��5��N��Oԭ�Ӱ뾶�ϴ����_______��
��6��H2S��HCl���ȶ��Խ�������______��
��7��Na2O��MgO����ˮ��Ӧ����______��
��8��Mg(OH)2��Al(OH)3����ǿ�Ӧ����______��
��9��������������������______(�Si����SiO2��)��
��10��������(HClO)����ɱ��Ư�����ã�����ClԪ�صĻ��ϼ�Ϊ____��HClO���ȶ����ֽ�����HCl��O2��д�����ڹ��������·ֽ�Ļ�ѧ����ʽ��____��