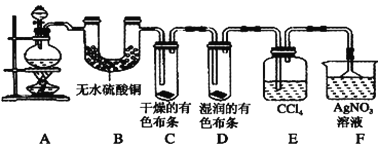
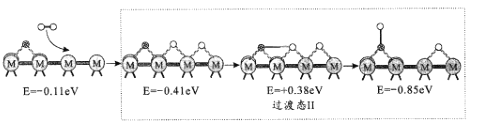
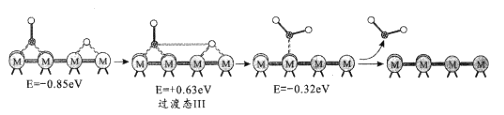
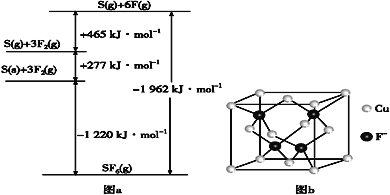
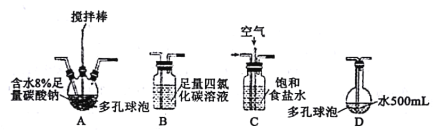
题目内容
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 常温常压下,15g甲基(-CH3)所含的电子数为10NA
B. 常温常压,11.2L氦气中含有的原子数为0.5NA
C. 标准状况下,4.48L重水(D2O)中含有的中子数为2NA
D. 常温常压下,23gNO2和N2O4的混合物中含有NA个氧原子
【答案】D
【解析】
A、1mol-CH3含有电子物质的量为9mol,15g甲基的物质的量为1mol,则含有电子物质的量为9mol,故A错误;
B、常温常压不是标准状况,因此不能直接用22.4L·mol-1进行计算,故B错误;
C、D2O在标准状况下,不是气体,不能用22.4L·mol-1进行计算,故C错误;
D、假设23g全部是NO2,则氧原子物质的量为![]() =1mol,假设23g全部是N2O4,则氧原子物质的量为
=1mol,假设23g全部是N2O4,则氧原子物质的量为![]() =1mol,因此23g的该混合物,含有氧原子物质的量为1mol,故D正确;
=1mol,因此23g的该混合物,含有氧原子物质的量为1mol,故D正确;
答案选D。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目