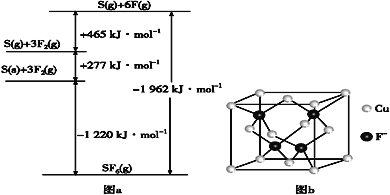
��Ŀ����
����Ŀ�����Ļ���������ɴ�����Ⱦ����Ҫ���ʡ��о����Ļ�����ķ�Ӧ������������������Ⱦ����Ҫ���塣
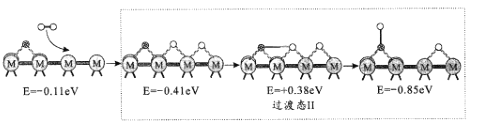
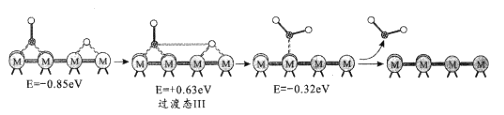
��1��NO�ڿ����д������·�Ӧ��2NO(g)+O2(g)![]() 2NO2(g)��H��������Ӧ��������ɣ��䷴Ӧ������ͼ��ʾ���ش��������⣺
2NO2(g)��H��������Ӧ��������ɣ��䷴Ӧ������ͼ��ʾ���ش��������⣺
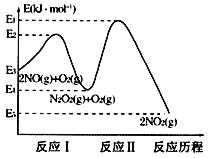
��д����ӦI���Ȼ�ѧ����ʽ___��
�ڶ����ܷ�Ӧ��2NO(g)+O2(g)![]() 2NO2(g)���Ը÷�Ӧ��ϵ�����¶ȷ����ܷ�Ӧ���ʷ�����������ԭ�������__(��Ӧδʹ�ô���)��
2NO2(g)���Ը÷�Ӧ��ϵ�����¶ȷ����ܷ�Ӧ���ʷ�����������ԭ�������__(��Ӧδʹ�ô���)��
��2���ý�̿��ԭNO2�ķ�ӦΪ2NO2(g)+2C(s)![]() N2(g)+2CO2(g)���ں��������£�1molNO2������C�����÷�Ӧ�����ƽ��ʱNO2��CO2�����ʵ���Ũ����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ��
N2(g)+2CO2(g)���ں��������£�1molNO2������C�����÷�Ӧ�����ƽ��ʱNO2��CO2�����ʵ���Ũ����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ��

��A��B�����Ũ��ƽ�ⳣ����ϵ��Kc(A)___Kc(B)(����<����>������=��)
��A��B��C������NO2��ת������͵���___(����A����B������C��)�㡣
�ۼ���C��ʱ�÷�Ӧ��ѹǿƽ�ⳣ��Kp(C)=___(Kp����ƽ���ѹ����ƽ��Ũ�ȼ���)
��3���绯ѧ�������������Լ�����������NH3�ĺ�����ԭ����ͼ��ʾ�������ĵ缫��ӦΪ___��������16.8L(��״��)�İ������봫�������뷴Ӧ����һ����Ҫͨ���״����O2�����Ϊ___��
���𰸡�2NO(g)![]() N2O2(g) ��H=��(E3-E4)kJ��mol-1 �¶����ߺ�ӦIƽ�������ƶ�������N2O2Ũ�ȼ�С���¶����߶Է�Ӧ���Ӱ������N2O2Ũ�ȼ�С��Ӱ�죬���·�Ӧ���ٶȱ����������ܷ�Ӧ���ʱ��� = B�� 4Mpa 2NH3-6e-+6OH-=N2+6H2O 12.6L
N2O2(g) ��H=��(E3-E4)kJ��mol-1 �¶����ߺ�ӦIƽ�������ƶ�������N2O2Ũ�ȼ�С���¶����߶Է�Ӧ���Ӱ������N2O2Ũ�ȼ�С��Ӱ�죬���·�Ӧ���ٶȱ����������ܷ�Ӧ���ʱ��� = B�� 4Mpa 2NH3-6e-+6OH-=N2+6H2O 12.6L
��������
��1���ٸ���������ϵͼ����ӦIΪ���ȷ�Ӧ���Ȼ�ѧ����ʽ2NO(g)![]() N2O2(g) ��H=��(E3-E4)kJ��mol-1 ���ʴ�Ϊ��2NO(g)
N2O2(g) ��H=��(E3-E4)kJ��mol-1 ���ʴ�Ϊ��2NO(g)![]() N2O2(g) ��H=��(E3-E4)kJ��mol-1 ��
N2O2(g) ��H=��(E3-E4)kJ��mol-1 ��
�ڷ�ӦI�ͷ�Ӧ���У���ӦI�ǿ췴Ӧ������ٽ���ƽ��״̬������Ӧ��������Ӧ������2NO(g)+O2(g)![]() 2NO2(g)��Ӧ���ʵ��Ƿ�Ӧ�����ܷ�Ӧ��2NO(g)+O2(g)
2NO2(g)��Ӧ���ʵ��Ƿ�Ӧ�����ܷ�Ӧ��2NO(g)+O2(g)![]() 2NO2(g)���Ը÷�Ӧ��ϵ�����¶ȷ����ܷ�Ӧ���ʷ�����������ԭ������ǣ��¶����ߺ�ӦIƽ�������ƶ�������N2O2Ũ�ȼ�С���¶����߶Է�Ӧ���Ӱ������N2O2Ũ�ȼ�С��Ӱ�죬���·�Ӧ���ٶȱ����������ܷ�Ӧ���ʱ���(��Ӧδʹ�ô���)���ʴ�Ϊ���¶����ߺ�ӦIƽ�������ƶ�������N2O2Ũ�ȼ�С���¶����߶Է�Ӧ���Ӱ������N2O2Ũ�ȼ�С��Ӱ�죬���·�Ӧ���ٶȱ����������ܷ�Ӧ���ʱ�����
2NO2(g)���Ը÷�Ӧ��ϵ�����¶ȷ����ܷ�Ӧ���ʷ�����������ԭ������ǣ��¶����ߺ�ӦIƽ�������ƶ�������N2O2Ũ�ȼ�С���¶����߶Է�Ӧ���Ӱ������N2O2Ũ�ȼ�С��Ӱ�죬���·�Ӧ���ٶȱ����������ܷ�Ӧ���ʱ���(��Ӧδʹ�ô���)���ʴ�Ϊ���¶����ߺ�ӦIƽ�������ƶ�������N2O2Ũ�ȼ�С���¶����߶Է�Ӧ���Ӱ������N2O2Ũ�ȼ�С��Ӱ�죬���·�Ӧ���ٶȱ����������ܷ�Ӧ���ʱ�����
��2����A��B������¶���ͬ��ƽ�ⳣ��Kֻ���¶��йأ�A��B�����Ũ��ƽ�ⳣ����ϵ��Kc(A)=Kc(B)���ʴ�Ϊ��=��
��2NO2(g)+2C(s)![]() N2(g)+2CO2(g)�Ǹ������������ķ�Ӧ������ѹǿƽ�������ƶ���A��B��C������NO2��ת������͵���B�㡣�ʴ�Ϊ��B��
N2(g)+2CO2(g)�Ǹ������������ķ�Ӧ������ѹǿƽ�������ƶ���A��B��C������NO2��ת������͵���B�㡣�ʴ�Ϊ��B��
��1mol NO2������C�����÷�Ӧ���跴Ӧ��������x��������ʽ��
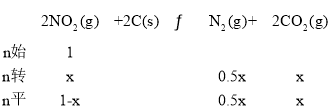
��ͼ֪C��ʱNO2��CO2�����ʵ���Ũ����ͬ����1-x=x�����x=0.5����ƽ��ʱ�ܵ����ʵ���Ϊ1.25mol������C��ʱ�÷�Ӧ��ѹǿƽ�ⳣ��Kp(C)=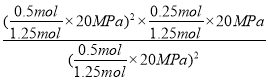 =4Mpa���ʴ�Ϊ��4Mpa��
=4Mpa���ʴ�Ϊ��4Mpa��
��3��ԭ����У�����ʧȥ���ӷ���������Ӧ������ͼ��֪��Ϊ�������ɵ������缫��ӦʽΪ��2NH3-6e��+6OH��=N2+6H2O�������ķ�ӦΪ��O2+4e��+H2O=4OH�����ݳ�����16.8L�����뷴Ӧ����Ϊ0.75mol����ת�Ƶ�����Ϊ2.25mol��������Ϊ![]() ��2.25mol=0.5625mol����ͨ���״����02�����Ϊ0.5625mol��22.4L��mol��1=12.6L��
��2.25mol=0.5625mol����ͨ���״����02�����Ϊ0.5625mol��22.4L��mol��1=12.6L��
�ʴ�Ϊ��2NH3-6e-+6OH-=N2+6H2O��12.6L��

 �ƸԹھ��ο���ϵ�д�
�ƸԹھ��ο���ϵ�д� ������ҵ��ͬ����ϰ��ϵ�д�
������ҵ��ͬ����ϰ��ϵ�д�