题目内容
【题目】金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和Ca,并含有3.5%(质量分数)CaO。
(1) Ca元素在周期表中位置是____,其原子结构示意图____。
(2) Ca与最活跃的非金属元素A形成化合物D,D的电子式为____,D的沸点比A与Si形成的化合物E的沸点____。
(3)配平用钙线氧脱鳞的化学方程式____:P+FeO+CaO![]() Ca3(PO4)2+Fe。
Ca3(PO4)2+Fe。
(4)将钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n,则金属M为______;检测Mn+的方法是_____(用离子方程式表达)。
(5)取1.6 g钙线试样,与水充分反应,生成224 mL H2(标准状况),再向溶液中通入适量的CO2,最多能得到CaCO3____g。
【答案】第四周期ⅡA族 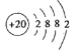
![]() 高 2P+5FeO+3CaO
高 2P+5FeO+3CaO![]() Ca3(PO4)2+5Fe Fe Fe3++3SCN-=Fe(SCN)3 1.1
Ca3(PO4)2+5Fe Fe Fe3++3SCN-=Fe(SCN)3 1.1
【解析】
(1)Ca元素为20号元素,在周期表中位置为第四周期ⅡA族;
(2)最活跃的非金属元素A为F,与Ca反应生成CaF2;离子化合物的沸点比分子晶体高;
(3)根据化合价升降法配平;
(4)白色絮状沉淀并迅速变成灰绿色,最后变成红褐色的物质为Fe(OH)3,可用KSCN验证Fe3+的存在;
(5)钙线试样中,根据Ca守恒计算。
(1)Ca元素为20号元素,在周期表中位置为第四周期ⅡA族,原子结构示意图为 ;
;
(2)最活跃的非金属元素A为F,与Ca反应生成CaF2,其电子式为![]() ;CaF2为离子化合物,SiF4为分子晶体,则CaF2的沸点高;
;CaF2为离子化合物,SiF4为分子晶体,则CaF2的沸点高;
(3)根据化合价升降法,P由0价变为+5价,Fe由+2价变为0价,磷酸根离子角标为2,则最小公倍数为10,则P的系数为2,FeO的系数为5,其它根据原子守恒配平,方程式为2P+5FeO+3CaO![]() Ca3(PO4)2+5Fe;
Ca3(PO4)2+5Fe;
(4)白色絮状沉淀并迅速变成灰绿色,最后变成红褐色的物质为Fe(OH)3,则金属M为Fe;Fe3++3SCN-=Fe(SCN)3溶液颜色变为血红色,可用KSCN验证Fe3+的存在;
(5) 钙线试样中,Ca与水反应生成氢气,224 mL H2(标准状况),为0.01mol,则生成0.01mol的Ca(OH)2,已知钙线式样中CaO含量为3.5%,1.6![]() 3.5%/56=0.001mol,则溶液中生成0.011mol的Ca(OH)2,可得到0.011mol的碳酸钙,即1.1g。
3.5%/56=0.001mol,则溶液中生成0.011mol的Ca(OH)2,可得到0.011mol的碳酸钙,即1.1g。