��Ŀ����
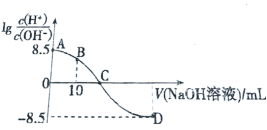
����Ŀ������β������NO�ķ�ӦΪ��N2(g)+O2(g)![]() 2NO(g)��һ�������£������ʵ�����N2(g)��O2(g)�ں����ܱ������з�Ӧ����ͼ����a��ʾ�÷�Ӧ���¶�T��N2��Ũ����ʱ��ı仯������b��ʾ�÷�Ӧ��ijһ��ʼ��Ӧ�����ı�ʱN2��Ũ����ʱ��ı仯������������ȷ����
2NO(g)��һ�������£������ʵ�����N2(g)��O2(g)�ں����ܱ������з�Ӧ����ͼ����a��ʾ�÷�Ӧ���¶�T��N2��Ũ����ʱ��ı仯������b��ʾ�÷�Ӧ��ijһ��ʼ��Ӧ�����ı�ʱN2��Ũ����ʱ��ı仯������������ȷ����

A.����b��Ӧ�������ı�����Ǽ����˴���
B.�¶�T�£����ŷ�Ӧ�Ľ��У����������ܶȼ�С
C.�¶�T�£��÷�Ӧ��ƽ�ⳣ��K =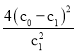
D.������b��Ӧ�������ı����¶ȣ����жϸ÷�Ӧ�����ȷ�Ӧ
���𰸡�CD
��������
A. ��ͼ��֪��b���ߵ�����ƽ��Ũ�ȼ�С��Ӧ��ƽ�ⷢ���ƶ�������ֻ�ܸı����ʣ�����ʹ��ѧƽ�ⷢ���ƶ�����b���߲��������ɴ���Ӱ��ģ�A����
B. ��Ӧ���������������壬���������m���䣬����Ϊ����������V���䣬��ô�ܶ���=![]() ���䣬B����
���䣬B����
C. ���ڷ�Ӧ��N2(g)+O2(g)![]() 2NO(g)����ʼʱ���ʵ�Ũ��c(N2)=c(O2)=c0 mol/L��c(NO)=0������ƽ��ʱc(N2)=c1 mol/L����Ӧ����(c0-c1) mol/L������ƽ��ʱc(O2)=c1 mol/L��c(NO)=2 (c0-c1) mol/L����÷�Ӧ�Ļ�ѧƽ�ⳣ��K=
2NO(g)����ʼʱ���ʵ�Ũ��c(N2)=c(O2)=c0 mol/L��c(NO)=0������ƽ��ʱc(N2)=c1 mol/L����Ӧ����(c0-c1) mol/L������ƽ��ʱc(O2)=c1 mol/L��c(NO)=2 (c0-c1) mol/L����÷�Ӧ�Ļ�ѧƽ�ⳣ��K=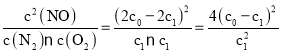 ��C��ȷ��
��C��ȷ��
D. ��ͼ��֪��b����ѧ��Ӧ���ʿ�(�仯���ȴ�)��������ƽ��Ũ�ȼ�С�������¶Ȼ�ѧ��Ӧ���ʼӿ죬��ѧƽ��������Ӧ�ƶ���������ӦΪ���ȷ�Ӧ������H>0��D��ȷ��
�ʺ���ѡ����CD��

 ��ĩ�óɼ�ϵ�д�
��ĩ�óɼ�ϵ�д� 99��1������ĩ��ѵ��ϵ�д�
99��1������ĩ��ѵ��ϵ�д� ��ǿ��У��ĩ���100��ϵ�д�
��ǿ��У��ĩ���100��ϵ�д� �óɼ�1��1��ĩ���100��ϵ�д�
�óɼ�1��1��ĩ���100��ϵ�д� ��״Ԫ���źþ�ϵ�д�
��״Ԫ���źþ�ϵ�д�