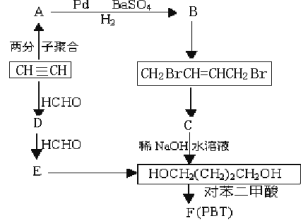
题目内容
【题目】已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有以下几种
①c(Cl-)>c(NH4+)>c(H+)>c(OH-)
②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
(1)上述关系一定不正确的是_______________(填序号);
(2)若溶液中只有一种溶质,则该溶质为__________,该溶液中离子浓度的大小关系为_______(填序号);
(3)若关系③正确,则溶液中溶质为_________;
(4)若四种离子浓度关系有c(NH4+)=c(Cl-),则该溶液显_________(填“酸性”、“碱性”、“中性”)。
(5)25℃,pH=a的盐酸VamL与pH=14-a的氨水VbmL混合,若溶液显中性,则Va__________Vb(填>、<、=、无法确定)。
【答案】② NH4Cl ① NH4Cl和NH3H2O 中性 >
【解析】
(1)任何水溶液都呈电中性,则溶液中阴阳离子所带电荷相等;
(2)任何水溶液中都有OH-、H+,若溶质只有一种则为NH4Cl,利用铵根离子水解使溶液显酸性来分析;
(3)由③中离子的关系可知溶液显碱性,且c(NH4+)>c(Cl-),则溶液为氯化铵和氨水的混合溶液;
(4)根据电荷守恒判断溶液的酸碱性;
(5)25℃,pH=a的盐酸中c(H+)=10-a mol/L,pH=14-a的氨水中c(OH-)=10-a mol/L,氯化氢是强电解质,一水合氨是弱电解质,所以盐酸浓度小于氨水浓度。
(1)任何水溶液都呈电中性,则溶液中阴阳离子所带电荷相等,这几个选项中只有②中阴离子电荷之和大于阳离子电荷之和,与水溶液呈电中性相违背,故②一定不正确;
(2)因任何水溶液中都有OH-、H+,若溶质只有一种则为NH4Cl,铵根离子水解方程式为NH4++H2O![]() NH3·H2O+H+,则c(Cl-)>c(NH4+),水解显酸性,则c(H+)>c(OH-),又水解的程度很弱,则c(Cl-)>c(NH4+)>c(H+)>c(OH-),即①符合;
NH3·H2O+H+,则c(Cl-)>c(NH4+),水解显酸性,则c(H+)>c(OH-),又水解的程度很弱,则c(Cl-)>c(NH4+)>c(H+)>c(OH-),即①符合;
(3)由③中离子的关系可知溶液显碱性,且c(NH4+)>c(Cl-),则溶液为氯化铵和氨水的混合溶液,其溶质为NH4Cl和NH3·H2O;
(4)若四种离子浓度关系有c(NH4+)=c(Cl-),根据电荷守恒知c(Cl-)+c(OH-)=c(NH4+)+c(H+),则c(H+)=c(OH-),所以溶液呈中性;
(5)25℃,pH=a的盐酸中c(H+)=10-amol/L,pH=14-a的氨水中c(OH-)=10-amol/L,氯化氢是强电解质,一水合氨是弱电解质,所以盐酸浓度小于氨水浓度,假设二者等体积混合,则氨水过量,混合溶液呈碱性,如果溶液呈中性,则酸的体积要大些,所以Va>Vb。