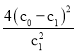��Ŀ����
����Ŀ��������һ����Ҫ�Ļ���ԭ�ϣ���ҵ�������������Ƶ����ƣ��Ʊ����Ƶķ�Ӧԭ��Ϊ��Na2SO4��s��+4H2��g��Na2S��s��+4H2O��g����Q����֪�ÿ��淴Ӧ��1000��ʱ�ﵽƽ�⣬�����ַ�Ӧ���ں��º��ݣ��Իش��������⣺
��1���˿��淴Ӧ��ƽ�ⳣ������ʽ�ɱ�ʾΪ______����ֻ�ı�һ��Ӱ�����أ���ƽ���ƶ�ʱ��Kֵ______�仯������һ����������һ����������Kֵ���ʱ���淴Ӧ����______��������������������С��������������
��2���÷�Ӧ�ﵽƽ��ʱ����˵���������______��
a��������ѹǿ���ֲ���
b��������ˮ���������ʵ���֮�ȱ��ֲ���
c����������Fe3O4���壬ƽ�����淴Ӧ�����ƶ�
d���Ƴ�����Na2S���壬ƽ��������Ӧ�����ƶ�
��3�����¶��£���2Lʢ��2.84g Na2SO4���ܱ�������ͨ��H2���壬10���Ӻ��ù�������Ϊ2.264g����10������H2��ƽ����Ӧ����Ϊ______��
��4����Ba��ClO��2��Һ��ͨ������SO2�������Һ�е�������______��
��5�������������еμӷ�̪����Һ��Ϊ��ɫ�����ڸ���Һ���ٵ��������BaCl2��Һ��������______���������ӷ���ʽ������ƽ��ԭ�����н��ͣ�______��
���𰸡�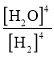 ��һ�� ���� d 0.0018 mol/��Lmin�� H2SO4 HCl ��ɫ�������ɣ���Һ��ɫ��ȥ ����������Һˮ��ɼ��ԣ������̪�ɺ�ɫ��SO32��+H2OHSO3��+OH���������Ȼ�����Ba2++SO32��=BaSO3����������SO32����Ũ�ȣ�ʹ��ˮ��ƽ�������ƶ���������Һ��OH��Ũ�Ƚ��ͣ������Һ��ɫ��ȥ
��һ�� ���� d 0.0018 mol/��Lmin�� H2SO4 HCl ��ɫ�������ɣ���Һ��ɫ��ȥ ����������Һˮ��ɼ��ԣ������̪�ɺ�ɫ��SO32��+H2OHSO3��+OH���������Ȼ�����Ba2++SO32��=BaSO3����������SO32����Ũ�ȣ�ʹ��ˮ��ƽ�������ƶ���������Һ��OH��Ũ�Ƚ��ͣ������Һ��ɫ��ȥ
��������
(1)��Ӧ��ƽ�ⳣ��=![]() ������ʹ�Һ�岻д�����ʽ��ƽ�ⳣ��ֻ���¶ȱ仯����Ӧ�����ȷ�Ӧ�����´ٽ�ƽ��������У�ƽ�ⳣ������
������ʹ�Һ�岻д�����ʽ��ƽ�ⳣ��ֻ���¶ȱ仯����Ӧ�����ȷ�Ӧ�����´ٽ�ƽ��������У�ƽ�ⳣ������
(2)��Ӧ�����������������ȷ�Ӧ����Ӧ�ﵽƽ��״̬�����淴Ӧ������ͬʱ������ֺ������ֲ��䣬��������˵����Ӧ�ﵽƽ��״̬��
(3)���ݷ���ʽ���㷴Ӧ�����������ʵ������������Ӧ���ʣ�
(4)��������ˮ��Һ�����ԣ�C1O�������������¾���ǿ�����ԣ��������������������ԭ��Ӧ���Դ˽����⣻
(5)����������ǿ�������Σ���������ˮ���ʹ��Һ�ʼ��ԣ������̪����Һ��죻�ٵ��������BaCl2��Һ������������Ӻͱ����ӷ�Ӧ���������ᱵ����������SO32��Ũ�ȼ�С��ˮ��ƽ�����ƣ�OH��Ũ�ȼ�С����Һ��ɫ���ݴ˼��ɽ��
(1)Na2SO4(s)+4H2(g)Na2S(s)+4H2O(g)����Ӧ��ƽ�ⳣ������ʽK=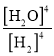 ��Ӱ�컯ѧƽ����������¶ȡ�ѹǿ��Ũ�ȵȣ��ı�һ������ƽ�ⷢ���ƶ�����ƽ�ⳣ��ֻ���¶ȱ仯������ѹǿ��Ũ�ȵĸı䣬������ֻ�ı�һ��Ӱ�����أ���ƽ���ƶ�ʱ��Kֵ��һ���仯����Ӧ�����ȷ�Ӧ����Kֵ���ʱ��˵�����¶�Ӱ�죬ƽ��������У�˵��������ƽ��������У����淴Ӧ���ʶ�����
��Ӱ�컯ѧƽ����������¶ȡ�ѹǿ��Ũ�ȵȣ��ı�һ������ƽ�ⷢ���ƶ�����ƽ�ⳣ��ֻ���¶ȱ仯������ѹǿ��Ũ�ȵĸı䣬������ֻ�ı�һ��Ӱ�����أ���ƽ���ƶ�ʱ��Kֵ��һ���仯����Ӧ�����ȷ�Ӧ����Kֵ���ʱ��˵�����¶�Ӱ�죬ƽ��������У�˵��������ƽ��������У����淴Ӧ���ʶ�����
(2)Na2SO4(s)+4H2(g)Na2S(s)+4H2O(g)����Ӧ�����������������ȷ�Ӧ��
a����Ӧǰ������������䣬��Ӧ������������ѹǿʼ�ձ��ֲ��䣬��Ӧ�ﵽƽ��״̬��ѹǿ���䣬��a��ȷ��
b����Ӧ�ﵽƽ��״̬�����ʵ������䣬������ˮ���������ʵ���֮�ȱ��ֲ��䣬��b��ȷ��
c�����岻Ӱ�컯ѧƽ�⣬��������Fe3O4���壬ƽ�ⲻ�����ƶ�����c��ȷ��
d�����岻Ӱ�컯ѧƽ�⣬�Ƴ�����Na2S���壬ƽ�ⲻ�����ƶ�����d����
(3)�跴Ӧ���ĵ�����Ϊnmol��
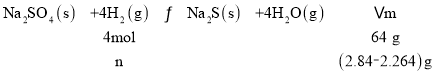
���n=0.036mol�����ʱ�䷶Χ�ڵ�ƽ����Ӧ����v(H2)=![]() �T0.0018mol/��Lmin����
�T0.0018mol/��Lmin����
(4)��Ba(C1O)2��Һ��ͨ������SO2���巢��Ba(C1O)2+2SO2+2H2O=BaSO4��+H2SO4+2HCl����Ӧ����Һ������ΪH2SO4��HCl��
(5)����������ǿ�������Σ���������ˮ���ʹ��Һ�ʼ��ԣ�SO32��+H2OHSO3��+OH���������̪����Һ��죻�ٵ��������BaCl2��Һ������������Ӻͱ����ӷ�Ӧ���������ᱵ������Ba2++SO32���TBaSO3��(��ɫ)������SO32��Ũ�ȼ�С��ˮ��ƽ�����ƣ�OH��Ũ�ȼ�С����Һ��ɫ��

����Ŀ�����������Ҫ�ɷֿɱ�ʾΪFeOCr2O3��������MgO��Al2O3��Fe2O3�����ʣ��������Ը�����Ϊԭ���Ʊ��ظ���أ�K2Cr2O7��������ͼ��
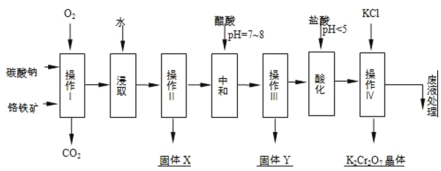
��֪��
��4FeOCr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2����
8Na2CrO4+2Fe2O3+8CO2����
��Na2CO3+Al2O3![]() 2NaAlO2+CO2����
2NaAlO2+CO2����
��������ش��������⣺
��1������I�ڳ����¸÷�Ӧ�ٶȼ��������д�ʩ����ʹ��Ӧ�����������______��
A�������¶� B��ͨ������Ŀ��� C����ԭ�Ϸ��� D�����Ӵ��������
��2������X����Ҫ����______����д��ѧʽ����
��3���ữ���������������ҺpH��5���������Ŀ����______�������ӷ���ʽ��ʾ��
��4������ iv�жಽ��ɣ����K2Cr2O7����IJ��������ǣ�����KCl���塢����Ũ����______��______��ϴ�ӡ����
��5������������ʵ��ܽ�����ݣ�������������Ӧ�Ļ�ѧ����ʽ�ǣ�Na2Cr2O7+2KCl��K2Cr2O7��+2NaCl��
�÷�Ӧ����Һ���ܷ�����������______��������˵����
���� | �ܽ��/��g/100gˮ�� | ||||
0��C | 40��C | 80��C | |||
KCl | 28 | 40.1 | 51.3 | ||
NaCl | 35.7 | 36.4 | 38 | ||
K2Cr2O7 | 4.7 | 26.3 | 73 | ||
Na2Cr2O7 | 163 | 215 | 376 | ||
��6������ƷY��Ҫ��������������������þ���������ܻ����P���������ʣ���ȷ����Y���������������ķ����dz�ȡn g��Ʒ���������______����д�Լ������ܽ⡢���ˡ���______����д�Լ����������ա���ȴ���������ø������m g��������Ʒ��������������������Ϊ______���ú�m��n�Ĵ���ʽ��ʾ����