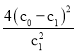题目内容
【题目】碳酸亚铁(FeCO3)是菱铁矿的主要成分,将FeCO3加热到200℃开始分解为FeO和CO2,若在空气中高温煅烧FeCO3则生成Fe2O3。据报道,一定条件下Fe2O3可被甲烷还原为“纳米级”的金属铁。其反应为:Fe2O3(s) + 3CH4(g)![]() 2Fe(s) + 3CO(g) + 6H2(g)-Q
2Fe(s) + 3CO(g) + 6H2(g)-Q
(1)原子序数为26的铁元素位于元素周期表的第________周期__________族。
(2)反应在5L的密闭容器中进行,2min后达到平衡,测得Fe2O3在反应中质量减少4.8g。则该段时间内H2的平均反应速率为____________________。
(3)将固定质量的Fe2O3(s)和CH4(g)置于恒温恒压容器中,在一定条件下反应,能表明该反应达到平衡状态的是__________________。
A、CH4的转化率等于CO的产率
B、混合气体的平均相对分子质量不变
C、v正(CO):v逆(H2)=1︰2
D、固体的总质量不变
(4)FeO可用CO进行还原,已知:t℃时, FeO(s) +CO(g) ![]() Fe(s) + CO2(g) K=0.5若在1 L密闭容器中加入0.04 mol FeO(s),并通入x molCO,t℃时反应达到平衡。此时FeO(s)的转化率为50%,则x=__________________________。
Fe(s) + CO2(g) K=0.5若在1 L密闭容器中加入0.04 mol FeO(s),并通入x molCO,t℃时反应达到平衡。此时FeO(s)的转化率为50%,则x=__________________________。
(5)Fe2O3还可用来制备FeCl3 ,FeCl3在水溶液中的水解分三步:
Fe3+ + H2O![]() Fe(OH)2+ + H+ K1
Fe(OH)2+ + H+ K1
Fe(OH)2+ + H2O![]() Fe(OH)2+ + H+ K2
Fe(OH)2+ + H+ K2
Fe(OH)2+ + H2O![]() Fe(OH)3 + H+ K3
Fe(OH)3 + H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是____________________。
(6)通过控制条件,以上水解产物聚合生成聚合物的离子方程式为:xFe3++yH2O![]() Fex(OH)(3x-y)+ y+yH+,欲使平衡正向移动可采用的方法是_________________________(填字母 )。
Fex(OH)(3x-y)+ y+yH+,欲使平衡正向移动可采用的方法是_________________________(填字母 )。
A、加水稀释 B、加入少量NaCl固体
C、升温 D、加入少量Na2CO3固体
【答案】四 VIII 0.018mol(Lmin)-1 BCD 0.06 K1>K2>K3 ACD
【解析】
(1) Fe元素位于第四周期第VIII族;
(2) n(Fe2O3)=![]() ,根据方程式知,有0.03mol氧化铁参加反应时有0.18mol氢气生成,根据v=
,根据方程式知,有0.03mol氧化铁参加反应时有0.18mol氢气生成,根据v=![]() ,计算该段时间内氢气平均反应速率;
,计算该段时间内氢气平均反应速率;
(3)可逆反应达到平衡状态时,该物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变;
(4)参加反应的n(FeO)=0.04mol×50%=0.02mol,根据方程式知,参加反应的n(CO)=n(CO2)=n(FeO)=0.02mol,容器的体积为1L,则平衡时c(CO)=![]() , c(CO2)=0.02mol/L,化学平衡常数K=
, c(CO2)=0.02mol/L,化学平衡常数K=![]() =0.5,据此计算x值;
=0.5,据此计算x值;
(5)多元弱碱水解时,其第一步水解程度远远大于第二步,第二步水解程度远远大于第三步;
(6)欲使平衡正向移动,可以采用加入和氢离子反应的物质、加水稀释、升高温度的方法。
(1)Fe元素位于第四周期第VIII族,故答案为:四;VIII;
(2) n(Fe2O3)=![]() ,根据方程式知,有0.03mol氧化铁参加反应时有0.18mol氢气生成,根据v=
,根据方程式知,有0.03mol氧化铁参加反应时有0.18mol氢气生成,根据v=![]() ,故答案为:0.018mol(Lmin)1;
,故答案为:0.018mol(Lmin)1;
(3)A. CH4的转化率等于CO的产率时,该反应不一定达到平衡状态,A项错误;
B. 混合气体的平均相对分子质量不变时,各物质的物质的量不变,该反应达到平衡状态,B项正确;
C. v正(CO):v逆(H2)=1:2时,同一物质的正逆反应速率相等,该反应达到平衡状态,C项正确;
D. 固体的总质量不变时,该反应达到平衡状态,故正确;故答案为:BCD;
(4) 参加反应的n(FeO)=0.04mol×50%=0.02mol,根据方程式知,参加反应的n(CO)=n(CO2)=n(FeO)=0.02mol,容器的体积为1L,则平衡时c(CO)=![]() , c(CO2)=0.02mol/L,化学平衡常数K=
, c(CO2)=0.02mol/L,化学平衡常数K=![]() =0.5解得x=0.06,故答案为:0.06;
=0.5解得x=0.06,故答案为:0.06;
(5)多元弱碱水解时,因为每一步水解都生成氢离子,氢离子的存在抑制水解,所以其第一步水解程度远远大于第二步,第二步水解程度远远大于第三步,则存在K1>K2>K3,故答案为:K1>K2>K3;
(6)欲使平衡正向移动,可以采用加入和氢离子反应的物质、加水稀释、升高温度的方法,故选ACD,故答案为:ACD。

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案