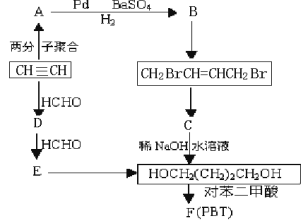
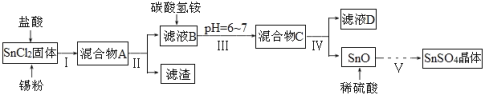
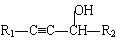题目内容
【题目】将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一氧化还原反应的体系,共有KCl、Cl2、浓H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质。完成下列填空:
(1)写出一个包含上述七种物质的氧化还原反应方程式,配平并标出电子转移方向和数目:___________________________。
(2)上述反应中,氧化剂是_____________,每转移1 mol电子,生成Cl2_____ L(标准状况)。
(3)在反应后的溶液中加入NaBiO3(不溶于冷水),溶液又变为紫红色,BiO3-反应后变为无色的Bi3+。写出该实验中涉及反应的离子反应方程式:_________________。
(4)根据以上实验,写出两个反应中氧化剂、氧化产物的氧化性强弱顺序__________。
(5)上述氧化还原反应体系中,属于第三周期元素的简单离子半径由大到小的顺序为________
(6)氯原子的最外层电子的轨道式为___________,氯原子核外有_______不同运动状态的电子。
【答案】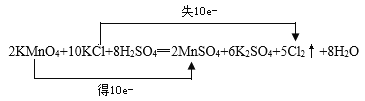 KMnO4 11.2 2Mn2++5NaBiO3+14H+=2MnO4-+5Na++5Bi3++7H2O NaBiO3>KMnO4>Cl2 S2->Cl-
KMnO4 11.2 2Mn2++5NaBiO3+14H+=2MnO4-+5Na++5Bi3++7H2O NaBiO3>KMnO4>Cl2 S2->Cl-  17
17
【解析】
(1)由浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去,则高锰酸钾具有氧化性,则还原反应为KMnO4→MnSO4,则在给出的物质中Cl元素的化合价升高,则氧化反应为KCl→Cl2,然后根据元素守恒来书写氧化还原反应;
(2)在氧化还原反应中,得电子化合价降低的反应物是氧化剂,根据氧化剂和转移电子之间的关系计算;
(3)在反应后的溶液中加入NaBiO3(不溶于冷水),溶液又变为紫红色,说明Mn2+被氧化变为MnO4-,BiO3-发生反应得到电子后变为无色的Bi3+,据此写出离子方程式;
(4)在自发进行的氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性;
(5)上述氧化还原反应体系中,属于第三周期元素有S、Cl,根据离子半径大小比较方法判断;
(6)根据构造原理可知氯原子的核外电子排布式,任何一个原子核外没有运动状态完全相同的电子存在;结合原子尽可能成单排列,而且自旋方向相同书写Cl原子最外层电子的轨道式。
(1)由题意可知,高锰酸钾具有氧化性,则还原反应为KMnO4→MnSO4,则在给出的物质中Cl元素的化合价升高,则氧化反应为KCl→Cl2,则反应为KMnO4+KCl+H2SO4→MnSO4+K2SO4+Cl2↑+H2O,由电子守恒及原子守恒可得配平后的化学反应为 ;
;
(2)2KMnO4+10KCl+8H2SO4=2MnSO4+6K2SO4+5Cl2↑+8H2O中,锰元素的化合价由+7变为+2,所以高锰酸钾是氧化剂,2 mol氧化剂在反应中得到电子的物质的量=2 mol×(7-2)=10 mol,每转移1 mol电子,生成Cl2是0.5 mol,其在标准状况下的体积为V(Cl2)=0.5 mol×22.4 L/mol=11.2 L;
(3)如果在反应后的溶液中加入NaBiO3,溶液又变紫红色,是因NaBiO3具有强氧化性(比KMnO4氧化性强),将Mn2+氧化为MnO4-,BiO3-得到电子被还原变为无色的Bi3+,根据电子守恒、电荷守恒及原子守恒,可得该反应的离子方程式为:2Mn2++5NaBiO3+14H+=2MnO4-+5Na++5Bi3++7H2O;
(4)在反应2KMnO4+10KCl+8H2SO4=2MnSO4+6K2SO4+5Cl2↑+8H2O中,物质的氧化性:KMnO4>Cl2;在反应2Mn2++5NaBiO3+14H+=2MnO4-+5Na++5Bi3++7H2O中,物质的氧化性:NaBiO3>KMnO4,所以氧化性强弱顺序是:NaBiO3>KMnO4>Cl2;
(5)上述氧化还原反应体系中,属于第三周期元素有硫和氯,S2-、Cl-核外电子排布都是2、8、8,电子层结构相同,由于核电荷数Cl>S,核电荷数越大,离子的半径就越小,所以其简单离子半径:S2->Cl-;
(6)Cl是17号元素,核外电子排布式是1s22s22p63s23p5,可见Cl原子最外层有7个电子,氯原子的最外层电子的轨道式为 ,氯原子核外有17不同运动状态的电子。
,氯原子核外有17不同运动状态的电子。

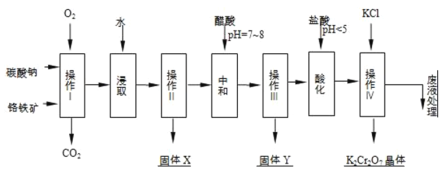
【题目】铬铁矿的主要成分可表示为FeOCr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
已知:
①4FeOCr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2↑;
8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3![]() 2NaAlO2+CO2↑;
2NaAlO2+CO2↑;
根据题意回答下列问题:
(1)操作I在常温下该反应速度极慢,下列措施中能使反应速率增大的是______.
A.升高温度 B.通入过量的空气 C.将原料粉碎 D.增加纯碱的用量
(2)固体X中主要含有______(填写化学式);
(3)酸化步骤用盐酸调节溶液pH<5,并煮沸其目的是______.(离子方程式表示)
(4)操作 iv有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、______、______、洗涤、干燥.
(5)表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl→K2Cr2O7↓+2NaCl.
该反应在溶液中能发生的理由是______.(文字说明)
物质 | 溶解度/(g/100g水) | ||||
0°C | 40°C | 80°C | |||
KCl | 28 | 40.1 | 51.3 | ||
NaCl | 35.7 | 36.4 | 38 | ||
K2Cr2O7 | 4.7 | 26.3 | 73 | ||
Na2Cr2O7 | 163 | 215 | 376 | ||
(6)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取n g样品,加入过量______(填写试剂)、溶解、过滤、再______(填写试剂)、…灼烧、冷却、称量,得干燥固体m g.计算样品中氢氧化铝的质量分数为______(用含m、n的代数式表示).