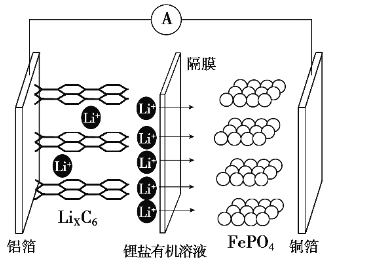
题目内容
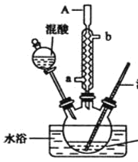
【题目】某同学设计如图所示装置制备一硝基甲苯
 甲苯
甲苯
已知.30℃左右主要产物为一硝基甲苯,温度过高时会生成二硝基甲苯和三硝基甲苯。
实验步骤如下.
①配制浓硫酸和浓硝酸(按体积比1.3)的混合物(混酸)
②在三颈瓶里装15ml甲苯
③装好其它药品,并组装好仪器
④向三颈烧瓶中加入混酸,并不断搅拌
⑤控制温度,大约反应10min至三颈烧瓶底有大量液体(淡黄色油状)出现
⑥分离出一硝基甲苯。(已知.甲苯的密度为0.866g/ml,沸点为110.6℃,硝基苯的密度为1.20g/ml,沸点为210.9℃)
根据上述实验,回答下列问题
(1)实验方案中缺少一个必要的仪器,它是___________。本实验的关键是控制温度在30℃左右在,如果温度过高,产生的后果是_____________________________________。
(2)简述配制混酸的方法_______________________________________________________,浓硫酸的作用是______________________________。
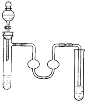
(3)A仪器的名称是_________________进水口是________________。
(4)写出甲苯与混酸反应生成间硝基甲苯的化学方程式___________________________。
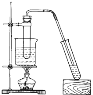
(5)分离产品方案如图所示
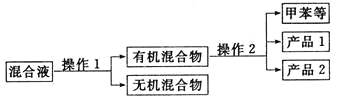
操作2的名称是_________________。
(6)经测定,产品1为一硝基甲苯,其核磁共拜氢谱中有3个峰,则其结构简式为_________________。
【答案】温度计 生成二硝基甲苯和三硝基甲苯 量取30ml浓硝酸倒入烧杯中,再量取10ml浓硫酸沿烧杯内壁缓缓注入烧杯并不断搅拌 催化剂、脱水剂 球形冷凝管 a ![]() +HNO3(浓)→
+HNO3(浓)→ 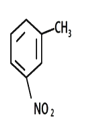 + H2O 蒸馏
+ H2O 蒸馏 ![]()
【解析】
(1)水浴加热需用温度计控制温度;温度过高时会生成二硝基甲苯和三硝基甲苯;
(2)浓硫酸稀释时释放大量的热,则配制混酸时应向硝酸中加入浓硫酸,边加边搅拌;浓硫酸在制取硝基苯时作催化剂和脱水剂;
(3)A仪器的名称为球形冷凝管,冷凝水应下进上出,即a口进;
(4)甲苯与浓硝酸在浓硫酸加热的条件下生成硝基甲苯和水;
(5)根据沸点不同分离多种相互溶解的物质采用蒸馏的方法;
(6)一硝基甲苯核磁共拜氢谱中有3个峰,则苯环上的氢原子对称,可确定硝基与甲基在苯环的对位。
(1)已知30℃左右主要产物为一硝基甲苯,装置需要水浴加热,需用温度计控制温度;温度过高时会生成二硝基甲苯和三硝基甲苯,本实验的关键是控制温度在30℃左右;
(2)浓硫酸稀释时释放大量的热,则配制混酸时应向硝酸中加入浓硫酸,边加边搅拌,方法为量取30ml浓硝酸倒入烧杯中,再量取10ml浓硫酸沿烧杯内壁缓缓注入烧杯并不断搅拌;浓硫酸在制取硝基苯时作催化剂和脱水剂;
(3)A仪器的名称为球形冷凝管,冷凝水应下进上出,即a口进;
(4)甲苯与浓硝酸在浓硫酸加热的条件下生成硝基甲苯和水,方程式为![]() +HNO3(浓)→
+HNO3(浓)→ 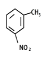 +H2O;
+H2O;
(5)根据沸点不同分离多种相互溶解的物质采用蒸馏的方法;
(6)产品1为一硝基甲苯,其核磁共拜氢谱中有3个峰,甲基上一种氢原子,则苯环上有二种,可确定硝基与甲基在苯环的对位,即![]() 。
。

 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案【题目】以下是处于研究阶段的“人工固氮”的新方法。N2在催化剂表面与水发生反应:2N2(g) +6H2O(l)![]() 4NH3(g) +3O2(g) △H=+1530.4 kJ/mol,完成下列填空:
4NH3(g) +3O2(g) △H=+1530.4 kJ/mol,完成下列填空:
(1)该反应平衡常数的表达式K=______________。
(2)上述反应达到平衡后,保持其他条件不变,升高温度,重新达到平衡时_______。
a. 平衡常数K增大 b. H2O的浓度减小
c. 容器内的压强增大 d. v逆(O2)减小
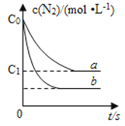
(3)部分实验数据见下表(条件:2 L容器、催化剂、光、N21 mol、水3 mol、反应时间3 h):
序号 | 第一组 | 第二组 | 第三组 | 第四组 |
t/℃ | 30 | 40 | 50 | 80 |
NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
第四组容器中3小时内以NH3表示的平均反应速率是______________。第四组容器内NH3生成量最小的可能原因是__________________。
(4)若用该反应进行工业生产,请选择适宜的条件________________。(答两条)
(5)工业合成氨时,合成塔中每产生1 mol NH3,放出46.1 kJ的热量,则工业合成氨的热化学方程式是_____________________。
(6)已知:N2(g)![]() 2N(g) H2(g)
2N(g) H2(g)![]() 2H(g),则断开1 mol N-H键所需的能量是_______kJ。
2H(g),则断开1 mol N-H键所需的能量是_______kJ。