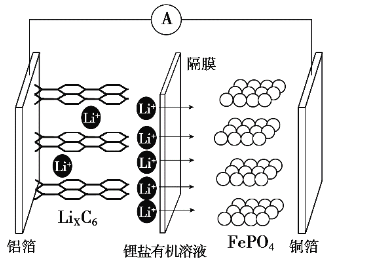
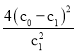题目内容
【题目】少量铁粉与100 mL 0.01 mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O ②加NaOH固体③滴入几滴浓盐酸 ④加CH3COONa固体 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10 mL 0.1 mol/L盐酸
A.①⑥⑦B.③⑤⑧C.③⑦⑧D.⑥⑦⑧
【答案】C
【解析】
涉及的离子方程式:![]() ,铁少量,氢气的产量由铁决定;①加水,物质的浓度降低,反应速率减慢;②加NaOH固体,与酸结合,反应物浓度降低,氢氧化钠足够多还会降低H2的产量;③滴入几滴浓盐酸,增大了反应物的浓度,可加快反应速率;④加CH3COONa固体,与氢反应,反应物浓度降低,反应速率减慢;⑤加NaCl溶液,对反应没有任何影响,所以不能加快反应速率;⑥加入几滴硫酸铜溶液,铁与铜离子会发生氧化还原反应,构成原电池,可加快反应速率,但是铁被消耗,H2的产量会减少;⑦升高温度,可加快反应速率;⑧改用10 mL 0.1 mol/L盐酸,增大物质的浓度,反应速率加快。
,铁少量,氢气的产量由铁决定;①加水,物质的浓度降低,反应速率减慢;②加NaOH固体,与酸结合,反应物浓度降低,氢氧化钠足够多还会降低H2的产量;③滴入几滴浓盐酸,增大了反应物的浓度,可加快反应速率;④加CH3COONa固体,与氢反应,反应物浓度降低,反应速率减慢;⑤加NaCl溶液,对反应没有任何影响,所以不能加快反应速率;⑥加入几滴硫酸铜溶液,铁与铜离子会发生氧化还原反应,构成原电池,可加快反应速率,但是铁被消耗,H2的产量会减少;⑦升高温度,可加快反应速率;⑧改用10 mL 0.1 mol/L盐酸,增大物质的浓度,反应速率加快。
A.①⑥不符合题意,故A错误;
B.⑤不符合题意,故B错误;
C.③⑦⑧均符合题意,C正确;
D.⑥不符合题意,故D错误;
答案选C。

 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案【题目】以下是处于研究阶段的“人工固氮”的新方法。N2在催化剂表面与水发生反应:2N2(g) +6H2O(l)![]() 4NH3(g) +3O2(g) △H=+1530.4 kJ/mol,完成下列填空:
4NH3(g) +3O2(g) △H=+1530.4 kJ/mol,完成下列填空:
(1)该反应平衡常数的表达式K=______________。
(2)上述反应达到平衡后,保持其他条件不变,升高温度,重新达到平衡时_______。
a. 平衡常数K增大 b. H2O的浓度减小
c. 容器内的压强增大 d. v逆(O2)减小
(3)部分实验数据见下表(条件:2 L容器、催化剂、光、N21 mol、水3 mol、反应时间3 h):
序号 | 第一组 | 第二组 | 第三组 | 第四组 |
t/℃ | 30 | 40 | 50 | 80 |
NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
第四组容器中3小时内以NH3表示的平均反应速率是______________。第四组容器内NH3生成量最小的可能原因是__________________。
(4)若用该反应进行工业生产,请选择适宜的条件________________。(答两条)
(5)工业合成氨时,合成塔中每产生1 mol NH3,放出46.1 kJ的热量,则工业合成氨的热化学方程式是_____________________。
(6)已知:N2(g)![]() 2N(g) H2(g)
2N(g) H2(g)![]() 2H(g),则断开1 mol N-H键所需的能量是_______kJ。
2H(g),则断开1 mol N-H键所需的能量是_______kJ。
【题目】铬铁矿的主要成分可表示为FeOCr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:
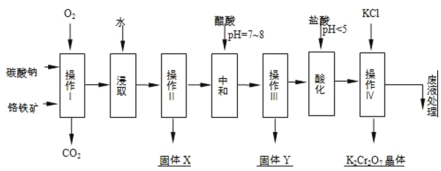
已知:
①4FeOCr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2↑;
8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3![]() 2NaAlO2+CO2↑;
2NaAlO2+CO2↑;
根据题意回答下列问题:
(1)操作I在常温下该反应速度极慢,下列措施中能使反应速率增大的是______.
A.升高温度 B.通入过量的空气 C.将原料粉碎 D.增加纯碱的用量
(2)固体X中主要含有______(填写化学式);
(3)酸化步骤用盐酸调节溶液pH<5,并煮沸其目的是______.(离子方程式表示)
(4)操作 iv有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、______、______、洗涤、干燥.
(5)表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl→K2Cr2O7↓+2NaCl.
该反应在溶液中能发生的理由是______.(文字说明)
物质 | 溶解度/(g/100g水) | ||||
0°C | 40°C | 80°C | |||
KCl | 28 | 40.1 | 51.3 | ||
NaCl | 35.7 | 36.4 | 38 | ||
K2Cr2O7 | 4.7 | 26.3 | 73 | ||
Na2Cr2O7 | 163 | 215 | 376 | ||
(6)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取n g样品,加入过量______(填写试剂)、溶解、过滤、再______(填写试剂)、…灼烧、冷却、称量,得干燥固体m g.计算样品中氢氧化铝的质量分数为______(用含m、n的代数式表示).