题目内容
15.近年来对CO2的利用和捕获已受到科学家们的广泛关注.如可利用CO2制甲醇,利用碱性溶液对CO2进行捕获等.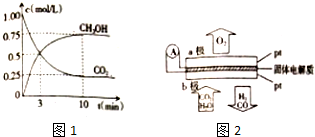
(1)已知CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)?CH2OH(g)+H2O(g)△H=akJ•mol-1.恒温下,向反应体系中加入固体催化剂,则该反应的反应热值a不变(填“增大”、“减小”或“不变”).
(2)在一恒温恒容密闭容器中充入1molCO2和3molH2,进行上述反应.测得CO2和CH2OH(g)的物质的量浓度随时间变化如图所示.则0~10min内,CO2的平均反应速率为0.075mol/(L.min).若第10min后,向该容器中再充入1.5molCO2和4.5molH2,则再次达到平衡时CH2OH(g)的体积分数增大.(填“增大”、“减小”或“不变”).
(3)甲醇燃料电池是以甲醇为燃料,氧气为氧化剂,使用酸性电解质,负极的反应式为CH3OH-6e-+H2O=CO2+6H+.
(4)据报道,有一种先进的电解方法可将CO2转换成CO和H2,反应原理为:CO2(g)+H2O(g)═CO(g)+H2(g)+O2(g).工作原理可用如图表示,图中A为电源,O2-可在固体电解质中移动.则a极为电解池的阳极极,CO2在b电极上放电的反应式是CO2+2e-=CO+O2-.
(5)用NaOH溶液捕获CO2后,其产物之一是NaHCO3,NaHCO3的水溶液呈碱性,原因是(用离子方程式和简要文字解释)碳酸氢根离子水解程度大于电离程度,导致溶液呈碱性,离子方程式为HCO3-+H2O?H2CO3+OH-、HCO3-?CO32-+H+.
分析 (1)催化剂只影响反应速率,不改变反应焓变;
(2)CO2的平均反应速率=$\frac{△c}{△t}$;若第10min后,向该容器中再充入1.5molCO2和4.5molH2,相当于增大压强,平衡正向移动;
(3)该燃料电池中,电解质溶液呈酸性,负极上甲醇失电子生成二氧化碳和氢离子;
(4)根据图知,a极上生成氧气,则氧离子失电子发生氧化反应,为阳极,b为阴极,b电极上二氧化碳得电子发生还原反应生成CO;
(5)碳酸氢钠是强碱弱酸酸式盐,碳酸氢根离子水解程度大于电离程度,导致碳酸氢钠溶液呈碱性.
解答 解:(1)催化剂只影响反应速率,不改变反应焓变,所以恒温下,向反应体系中加入固体催化剂,则该反应的反应热值a不变,故答案为:不变;
(2)CO2的平均反应速率=$\frac{△c}{△t}$=$\frac{1.00-0.25}{10}$mol/(L.min)=0.075mol/(L.min);若第10min后,向该容器中再充入1.5molCO2和4.5molH2,相当于增大压强,平衡正向移动,甲醇的含量增大,
故答案为:0.075mol/(L.min);增大;
(3)该燃料电池中,电解质溶液呈酸性,负极上甲醇失电子生成二氧化碳和氢离子,电极反应式为CH3OH-6e-+H2O=CO2+6H+,
故答案为:CH3OH-6e-+H2O=CO2+6H+;
(4)根据图知,a极上生成氧气,则氧离子失电子发生氧化反应,为阳极,b为阴极,b电极上二氧化碳得电子发生还原反应生成CO,电极反应式为CO2+2e-=CO+O2-,
故答案为:阳极;CO2+2e-=CO+O2-;
(5)碳酸氢钠是强碱弱酸酸式盐,碳酸氢根离子水解程度大于电离程度,导致碳酸氢钠溶液呈碱性.,离子方程式为HCO3-+H2O?H2CO3+OH-、HCO3-?CO32-+H+,
故答案为:碱;碳酸氢根离子水解程度大于电离程度,导致溶液呈碱性,离子方程式为HCO3-+H2O?H2CO3+OH-、HCO3-?CO32-+H+.
点评 本题考查化学反应原理,涉及盐类水解、原电池和电解池原理、化学平衡计算等知识点,难点是电极反应式的书写,注意:书写电极反应式要结合电解质特点书写,常见的燃料电池电解质有:酸溶液、碱溶液、熔融碳酸盐、熔融金属氧化物,电解质不同,电极反应式不同.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 使用石蕊试纸检验气体需要现用蒸馏水湿润 | |
| B. | 使用容量瓶要先检查是否漏水 | |
| C. | 使用锥形瓶进行酸碱中和滴定要先用待测液润洗 | |
| D. | 使用棕色瓶保存浓硝酸 |
| 选项 | 实验 | 现象 | 离子方程式 |
| A | 向氯化铝溶液中滴加过量氨水 | 有白色沉淀产生 | Al3++3OH-=Al(OH)3↓ |
| B | 向FeBr2溶液中通入少量氯气 | 溶液由浅绿色变成黄色 | 2Fe2++Cl2=2Fe3++2Cl- |
| C | 向稀硝酸中加入单质Fe粉 | 有气泡生成 | Fe+6H+=3Fe3++3H2↑ |
| D | 向Na2CO3溶液中滴加酚酞试剂 | 溶液由无色变为红色 | CO32-+H2O=H2CO3+2OH- |
| A. | A | B. | B | C. | C | D. | D |
| A. | 有大量的氯气泄漏时,用肥皂水浸湿软布蒙面,并迅速离开现场 | |
| B. | 用铂丝蘸取某溶液置于酒精灯火焰上灼烧,直接观察火焰颜色,检验K+的存在 | |
| C. | 少量的钠保存在煤油中 | |
| D. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| A. | 磁性氧化铁溶于盐酸:Fe2O3+6H+=2Fe3++3H2O | |
| B. | 淀粉碘化钾溶液在空气中变蓝:4I-+O2+2H2O=2I2+4OH- | |
| C. | Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑ | |
| D. | 氯气溶于水制备次氯酸:Cl2+H2O=2H++Cl-+ClO- |
 ;
;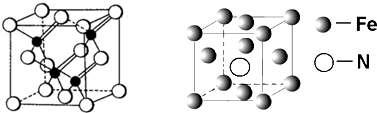
 ,形成该化合物的化学键有离子键和共价键
,形成该化合物的化学键有离子键和共价键 ,元素Z在周期表中的位置是第三周期ⅣA族.
,元素Z在周期表中的位置是第三周期ⅣA族.