题目内容
5.能正确表示下列反应的离子方程式是( )| A. | 磁性氧化铁溶于盐酸:Fe2O3+6H+=2Fe3++3H2O | |
| B. | 淀粉碘化钾溶液在空气中变蓝:4I-+O2+2H2O=2I2+4OH- | |
| C. | Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑ | |
| D. | 氯气溶于水制备次氯酸:Cl2+H2O=2H++Cl-+ClO- |
分析 A.磁性氧化铁为四氧化三铁,不是氧化铁,四氧化三铁与盐酸反应生成氯化铁、氯化亚铁和水;
B.碘离子被空气中的氧气氧化成碘单质,碘单质遇到淀粉显示蓝色;
C.2mol过氧化钠与水反应生成1mol氧气,该反应不满足电子守恒;
D.次氯酸为弱电解质,离子方程式中次氯酸不能拆开.
解答 解:A.磁性氧化铁的化学式为四氧化三铁,将磁性氧化铁溶于盐酸的离子反应为:Fe3O4+8H+=2Fe3++Fe2++4H2O,故A错误;
B.淀粉碘化钾溶液在空气中,碘离子被氧气氧化成碘单质,碘单质遇到淀粉变蓝,反应的离子方程式为:4I-+O2+2H2O=2I2+4OH-,故B正确;
C.Na2O2与H2O反应制备O2,离子方程式必须满足电子守恒,正确的离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑,故C错误;
D.氯气溶于水制备次氯酸,次氯酸需要保留分子式,正确的离子方程式为:Cl2+H2O=H++Cl-+HClO,故D错误;
故选B.
点评 本题考查了离子方程式的书写判断,为中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等).

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.用下列实验装置进行实验,能达到相应实验目的是( )
| A. | 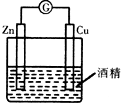 形成原电池 | B. | 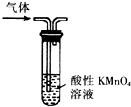 除去乙烯中混有的SO2 | ||
| C. | 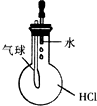 验证HCl气体在水中的溶解性 | D. | 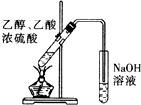 实验室制取乙酸乙酯 |
13.在反应A(s)+B(g)═2C(g)中,可使反应速率增大的措施是( )
①升高温度②降低压强③通入B气体④增加A的量⑤将块状固体A磨成粉末.
①升高温度②降低压强③通入B气体④增加A的量⑤将块状固体A磨成粉末.
| A. | ①③⑤ | B. | ①②④ | C. | ①④⑤ | D. | ①②③④⑤ |
20.对子KC1O3+6HCl=KCl+3C12↑+3H2O说法正确的是( )
| A. | 该反应属于置换反应 | |
| B. | 该反应利用了KClO3的强氧化性 | |
| C. | 氧化剂与还原剂的物质的量之比为1:6 | |
| D. | 该反应中有5mo1电子转移时,则一定生成67.2L Cl2 |
17.水溶液中可能存在Na+、Al3+、Fe2+、NH4+、NO3-、CO32-、SO42-中的若干离子,且存在的各离子具有相同的物质的量,某同学对该溶液进行如下实验,下列判断有误的是( )
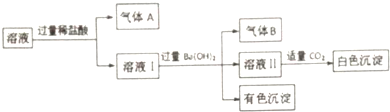

| A. | 气体A一定没有CO2,气体B一定是NH3 | |
| B. | 有色沉淀一定是混合物 | |
| C. | Na+可能存在于该溶液中 | |
| D. | 白色沉淀中一定没有Al(OH)3 |
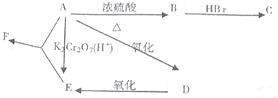
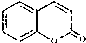 )是一种用途广泛的香料,其合成路线如图:
)是一种用途广泛的香料,其合成路线如图: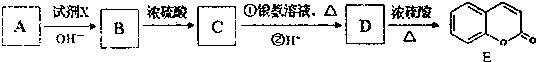
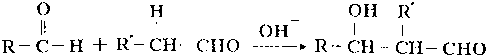
 ;
;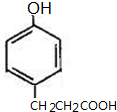 、
、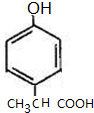 (写出一种即可).
(写出一种即可).