题目内容
10.第四周期中的18中元素具有重要的用途,在现代工业中备受青睐.(1)铬是一种硬二脆,抗腐蚀性强的金属,常用于电镀和制造特种钢.基态Cr原子中,电子占据最高能层的符号为N,该能层上具有的原子轨道数为16,电子数为1,
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,30Zn与31Ga的第一电离能是否符合这一规律?否(填“是”或“否”),原因是30Zn的4s能级有2个电子,处于全满状态,较稳定(如果前一问填“是”,此问可以不答)
(3)镓与第VA族元素可形成多种新型人工半导体材料,砷化镓(GaAs)就是其中一种,其晶体结构如下图所示(白色球代表As原子).在GaAs晶体中,每个Ga原子与4个As原子相连,与同一个Ga原子相连的As原子构成的空间构型为正四面体;
(4)与As同主族的短周期元素是N、P.AsH3中心原子杂化的类型sp3;一定压强下将AsH3和NH3.PH3的混合气体降温是首先液化的是NH3,理由是NH3分子之间有氢键,沸点较高;
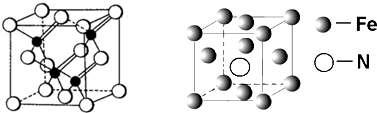
(5)铁的多种化合物均为磁性材料,氮化铁石期中一种,某氮化铁的井胞结构如图所示,则氮化铁的化学式为Fe4N;设晶胞边长为acm,阿伏加德罗常数为NA,该晶体的密度为$\frac{238}{{N}_{A}{a}^{3}}$g.cm-3(用含a和NA的式子表示)
分析 (1)根据铬的核外电子排布规律可知,铬在最外层是N层,有2个电子,据此答题;
(2)原子的最外层电子数处于半满或全满时,是一种稳定结构,此时原子的第一电离能都高于同周期相邻的元素;
(3)根据晶胞结构图,砷化镓结构中,As位于晶胞的面心和顶点上,Ga位于由四个As原子形成的四面体的体心,据此判断;
(4)与As同主族的短周期元素是N、P,所经AsH3的结构应与NH3相似,NH3分子之间有氢键,沸点较高;
(5)根据均摊法在氮化铁晶胞中,含有N原子数为1,Fe原子数为$1×\frac{1}{8}+6×\frac{1}{2}$=4,进而确定氮化铁的化学式,根据$ρ=\frac{m}{V}$计算密度;
解答 解:(1)铬的核外电子排布式为1s22s22p63s23p63d54s1,所以铬在最外层是N层,有1个电子,N层上原子轨道为spdf四种,共有轨道数为1+3+5+7=16,
故答案为:N;16;1;
(2)原子的最外层电子数处于半满或全满时,是一种稳定结构,此时原子的第一电离能都高于同周期相邻的元素,30Zn的4s能级有2个电子,处于全满状态,较稳定,所以30Zn与31Ga的第一电离能不符合逐渐增大的规律,
故答案为:否;30Zn的4s能级有2个电子,处于全满状态,较稳定;
(3)根据晶胞结构图,砷化镓结构中,As位于晶胞的面心和顶点上,Ga位于由四个As原子形成的四面体的体心,所以每个Ga原子与4个As原子相连,与同一个Ga原子相连的As原子构成的空间构型为正四面体,
故答案为:4;正四面体;
(4)氨分子中氮原子按sp3方式杂化,N与As同主族,所经AsH3的结构应与NH3相似,AsH3中心原子杂化的类型为sp3,NH3分子之间有氢键,沸点较高,所以一定压强下将AsH3和NH3.PH3的混合气体降温是首先液化的是NH3,
故答案为:sp3;NH3;NH3分子之间有氢键,沸点较高;
(5)根据均摊法在氮化铁晶胞中,含有N原子数为1,Fe原子数为$1×\frac{1}{8}+6×\frac{1}{2}$=4,所以氮化铁的化学式Fe4N,晶胞的体积为a3cm3,所以$ρ=\frac{m}{V}$=$\frac{\frac{14+56×4}{{N}_{A}}}{{a}^{3}}$g.cm-3=$\frac{238}{{N}_{A}{a}^{3}}$g.cm-3,
故答案为:Fe4N;$\frac{238}{{N}_{A}{a}^{3}}$;
点评 本题考查较为综合,原子结构、第一电离能、晶胞的结构及晶体计算、氢键等知识,题目难度中等,注意原子核外电子排布与物质性质的关系,当价层电子轨道处于全空、全充满、半充满时,较稳定.

| A. | △H4=△H1+△H3-△H2 | B. | △H4=△H1+2△H3-△H2 | ||
| C. | △H4=△H2+△H1+2△H3 | D. | △H4=2(△H2-△H1+2△H3) |
| A. | 9种 | B. | 8种 | C. | 7种 | D. | 6种 |
| A. | agC2H4和C3H6的混合物所含碳氢键数目为$\frac{a{N}_{A}}{7}$ | |
| B. | 2.24L12C18O或14N2所含的电子数为1.4NA | |
| C. | 1L0.1mol/L的CuSO4溶液中含有Cu2+的数目为0.1NA | |
| D. | 25℃时,在PH=12的1.0LBa(OH)2溶液中含有OH-的数目为0.02NA |
| A. | ①③④⑥⑦ | B. | 除外②都是 | C. | ①④⑥⑦ | D. | ①③④⑦ |
| A. | 由H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,可知:含1mol CH3COOH的溶液与含1mol NaOH的溶液混合,放出热量等于57.3 kJ | |
| B. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 | |
| C. | 2gH2完全燃烧生成液态水放出285.8kJ热量,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)═2 H2O(l)△H=-285.8kJ/mol | |
| D. | 从C(石墨)=C(金刚石)△H=+1.9kJ/mol,可知石墨比金刚石更稳定 |
| A. | 该反应属于置换反应 | |
| B. | 该反应利用了KClO3的强氧化性 | |
| C. | 氧化剂与还原剂的物质的量之比为1:6 | |
| D. | 该反应中有5mo1电子转移时,则一定生成67.2L Cl2 |