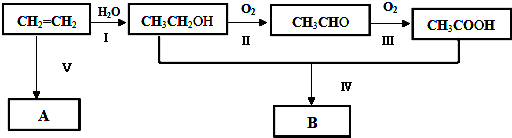
题目内容
6.下列使用仪器或用品的操作错误的是( )| A. | 使用石蕊试纸检验气体需要现用蒸馏水湿润 | |
| B. | 使用容量瓶要先检查是否漏水 | |
| C. | 使用锥形瓶进行酸碱中和滴定要先用待测液润洗 | |
| D. | 使用棕色瓶保存浓硝酸 |
分析 A、使用石蕊试纸检验气体必须润湿;
B、容量瓶使用前需检验是否漏水;
C、锥形瓶不能利用待测液润洗;
D、浓硝酸见光容易分解,据此解答即可.
解答 解:A、利用试纸检验气体时,必须首先润湿试纸,故A正确;
B、容量瓶为精密带盖仪器,使用前需要检验是否漏水,故B正确;
C、锥形瓶的使用不能利用所装溶液润洗,故C错误;
D、浓硝酸见光溶液分解,需要利用棕色瓶盛装,故D正确,
故选C.
点评 本题主要考查的是试纸的使用、仪器的使用、常见试剂的正确存放方法等,难度不大,掌握基础是关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.已知电离平衡常数:H2CO3>HClO>HCO3-,下列有关离子反应及其应用的叙述$\underset{不}{•}$$\underset{正}{•}$$\underset{确}{•}$的是( )
| A. | 将足量SO2通入含Fe2+、Cl-、Ba2+、Al3+的溶液中,四种离子仍能大量共存 | |
| B. | 向NaClO溶液中通入少量二氧化碳的离子方程式:2ClO-+CO2+H2O═2HClO+CO32- | |
| C. | 氢氧化铁与足量的HBr溶液反应的离子方程式:Fe(OH)2+3H+═Fe2++3H2O | |
| D. | 将100mL1mol•L-1的FeCl3溶液与足量NaS固体充分反应,生成沉淀10.4g |
17.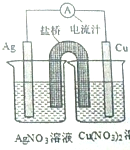 某同学用铜片,银片,Cu(NO3)2溶液,AgNO3溶液,导线和盐桥(装有琼脂-KN03的U形管)设计一个原电池如图所示,下列判断中正确的是( )
某同学用铜片,银片,Cu(NO3)2溶液,AgNO3溶液,导线和盐桥(装有琼脂-KN03的U形管)设计一个原电池如图所示,下列判断中正确的是( )
 某同学用铜片,银片,Cu(NO3)2溶液,AgNO3溶液,导线和盐桥(装有琼脂-KN03的U形管)设计一个原电池如图所示,下列判断中正确的是( )
某同学用铜片,银片,Cu(NO3)2溶液,AgNO3溶液,导线和盐桥(装有琼脂-KN03的U形管)设计一个原电池如图所示,下列判断中正确的是( )| A. | 实验过程中,左右两侧烧杯中,NO3-浓度变化情况分别为不变,增大 | |
| B. | 实验过程中,取出盐桥,该原电池也能继续工作 | |
| C. | 若开始使用U形铜管代替盐桥,装置中有电流产生,铜管质量不变 | |
| D. | 若开始时用U形铜管代替盐桥,装置中无电流产生 |
1.NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:2CO(g)+2NO(g)?N2(g)+2CO2(g)△H1.已知2NO(g)+O2(g)═2NO2(g)△H2;CO的燃烧热△H3;2NO2(g)+4CO(g)═N2(g)+4CO2(g)△H4;则下列关系式正确的是( )
| A. | △H4=△H1+△H3-△H2 | B. | △H4=△H1+2△H3-△H2 | ||
| C. | △H4=△H2+△H1+2△H3 | D. | △H4=2(△H2-△H1+2△H3) |
11.对于放热反应H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl,下列说法正确的是( )
| A. | 该反应涉及到离子键和共价键的断裂与形成 | |
| B. | 该反应中,化学能只转变为热能 | |
| C. | 断开1molH-H键和1molCl-Cl键所吸收的总能量,小于形成1molH-Cl键所放出的能量 | |
| D. | 反应物所具有的总能量高于产物所具有的总能量 |
18.分子式为C5H10O2且属于酯的同分异构体有( )
| A. | 9种 | B. | 8种 | C. | 7种 | D. | 6种 |
16.用下列实验装置进行实验,能达到相应实验目的是( )
| A. | 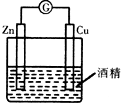 形成原电池 | B. | 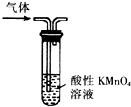 除去乙烯中混有的SO2 | ||
| C. | 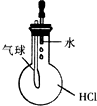 验证HCl气体在水中的溶解性 | D. | 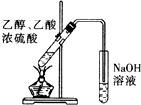 实验室制取乙酸乙酯 |