题目内容
20.三种短周期元素X、Y、Z两两之间可形成原子个数比均为1:1的三种化合物A、B、C.已知A、B均为离子晶体,构成A晶体的阴离子X-和构成B晶体的阳离子Z+分别与He和Ne具有相同的核外电子排布,常温下,A、B与水都能发生剧烈反应,分别生成无色气体R和W;由X、Y两元素组成的化合物C的水溶液中加入少量MnO2,也发生剧烈反应,放出气体W.据此回答:(1)Z元素在周期中位置是第三周期第IA族
(2)写出C的水溶液中加入MnO2所发生反应的化学方程式2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(3)化合物B的电子式为
 ,形成该化合物的化学键有离子键和共价键
,形成该化合物的化学键有离子键和共价键(4)写出A与水反应的化学方程式NaH+H2O=NaOH+H2↑.
分析 三种短周期元素X、Y、Z两两之间可形成原子个数比均为1:1的三种化合物A、B、C;A、B均为离子晶体,构成A晶体的阴离子X-和构成B晶体的阳离子Z+分别与He和Ne具有相同的核外电子排布,则X为H、Z为Na元素;由X、Y两元素组成的化合物C的水溶液中加入少量MnO2,也发生剧烈反应,放出气体W,则H、O元素组成的化合物过氧化氢能分解生成氧气和水,所以C是H2O2、W是O2,所以Y是O元素;
常温下,A、B与水都能发生剧烈反应,分别生成无色气体R和W,则A是NaH、B是Na2O2,R是H2;再结合题目分析解答.
解答 解:三种短周期元素X、Y、Z两两之间可形成原子个数比均为1:1的三种化合物A、B、C;A、B均为离子晶体,构成A晶体的阴离子X-和构成B晶体的阳离子Z+分别与He和Ne具有相同的核外电子排布,则X为H、Z为Na元素;由X、Y两元素组成的化合物C的水溶液中加入少量MnO2,也发生剧烈反应,放出气体W,则H、O元素组成的化合物过氧化氢能分解生成氧气和水,所以C是H2O2、W是O2,所以Y是O元素;
常温下,A、B与水都能发生剧烈反应,分别生成无色气体R和W,则A是NaH、B是Na2O2,R是H2;
(1)Z是Na元素,其原子核外有3个电子层、最外层电子数是1,所以位于第三周期IA,
故答案为:第三周期第IA族;
(2)C是双氧水,在二氧化锰作催化剂条件下分解生成水和氧气,反应方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,故答案为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(3)B是过氧化钠,电子式为 ,钠离子和过氧根离子之间存在离子键、O-O原子之间存在共价键,
,钠离子和过氧根离子之间存在离子键、O-O原子之间存在共价键,
故答案为: ;离子键和共价键;
;离子键和共价键;
(4)A是NaH,NaH和水反应生成NaOH和氢气,反应方程式为NaH+H2O=NaOH+H2↑,故答案为:NaH+H2O=NaOH+H2↑.
点评 本题考查位置结构性质相互关系及应用,为高频考点,侧重考查原子结构、元素周期表结构和物质结构,正确判断元素是解本题关键,注意过氧化钠中电子式的书写方法,题目难度不大.

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ |
(2)这些元素的最高价氧化物的对应水化物中,酸性最强的化合物的分子式是HClO4;碱性最强的化合物的电子式是
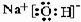 ;能形成两性氢氧化物的元素是Al.
;能形成两性氢氧化物的元素是Al.(3)②的氢化物分子式为NH3,属于共价化合物(填“共价”或“离子”);
(4)⑤元素的原子结构示意图为
 .
. | A. | 该反应涉及到离子键和共价键的断裂与形成 | |
| B. | 该反应中,化学能只转变为热能 | |
| C. | 断开1molH-H键和1molCl-Cl键所吸收的总能量,小于形成1molH-Cl键所放出的能量 | |
| D. | 反应物所具有的总能量高于产物所具有的总能量 |
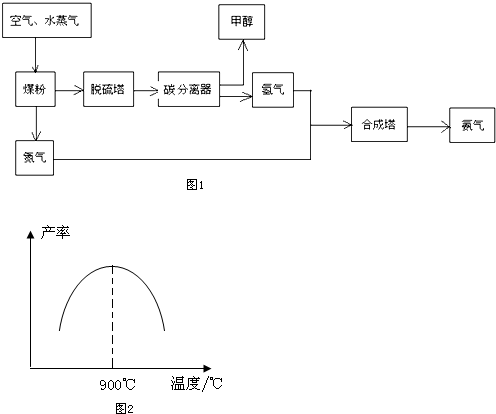
请回答下列问题:
(1)工业生产时,水蒸气可与煤粉反应制备H2,反应的化学方程式为C+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO+H2;
(2)工业制取氢气的另一个反应为:CO+H2O(g)?CO2+H2.在T℃时,往1L密闭容器中充入0.2molCO和0.3mol水蒸气,反应达平衡后,体系中c(H2)═0.12mol•L-1.该温度下此反应的平衡常数K=1(填计算结果);
(3)若在恒温恒容的容器内进行反应CO(g)+2H2 (g)?C H3OH(g),在密闭容器中开始只加入CO、H2,反应10min后测得各组分的浓度如下:
| 物质 | H2 | CO | C H3OH |
| 浓度/(mol•L-1) | 0.20 | o.10 | o.40 |
②该反应达到平衡状态的标志是BC(填字母序号);
A.有1个H-H键生成的同时有3个C-H键生成
B.CO的百分含量保持不变
C.容器中混合气体的压强不变化
D.容器中混合气体的密度不变化
(4)已知在常温常压下:
①2C H3OH(l)+3O2 (g)?2CO2 (g)+4H2 O(g)△H1=-1275.6kJ/mol
②2C O(l)+O2 (g)?2CO2 (g)△H2=-566.0kJ/mol
③H2O (g)?H2 O(l)△H3=-44.0kJ/mol
写出甲醇不完燃烧生成一氧化碳和液态水的热化学方程式CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8kJ•mol-1;
(5)N2和H2以铁作催化剂从145℃就开始反应,不同温度下NH3的产率如图2所示.温度高于900℃时,NH3产率下降的原因是温度高于900℃时,平衡向左移动;生产过程中合成气要进行循环,其目的是提高原料的利用率.
| A. | 二氧化碳与赤热的炭反应生成一氧化碳 | |
| B. | 葡萄糖在人体内氧化分解 | |
| C. | 锌粒与稀H2SO4反应制取H2 | |
| D. | Ba(OH)2•8H2O与NH4Cl反应 |
| A. | 戊烷 | B. | 戊烯 | C. | 戊醇 | D. | 戊酸 |
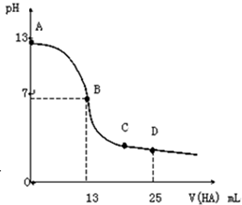 常温下,向25mL0.1mol•L-1MOH溶液中逐滴加入0.2mol•L-1HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:
常温下,向25mL0.1mol•L-1MOH溶液中逐滴加入0.2mol•L-1HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题: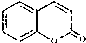 )是一种用途广泛的香料,其合成路线如图:
)是一种用途广泛的香料,其合成路线如图: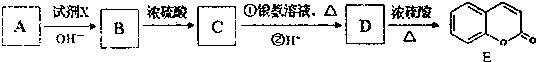
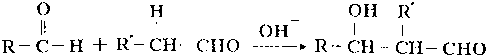
 ;
;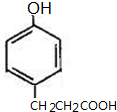 、
、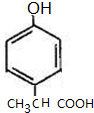 (写出一种即可).
(写出一种即可).