题目内容
20.已知硒是元素周期表中第四周期第ⅥA族元素,关于硒的性质判断肯定不正确的是( )| A. | 硒的含氧化合物以Se2O3形式存在 | |
| B. | 硒的含氢化合物以H2Se形式存在 | |
| C. | 硒的氢化物的稳定性比硫化氢差 | |
| D. | 硒的最高价氧化物对应水化物的化学式是H2SeO4 |
分析 A.Se位于第VAI族,在氧化物中化合价呈现+4价、+6价;
B.Se位于第VIA族,在氢化物中化合价呈现-2价;
C.元素的非金属性越强,其氢化物的稳定性越强;
D.Se和S属于同一主族元素,其最高价氧化物的水化物分子式相同.
解答 解:A.硒位于第VIA族,在氧化物中以+4价、+6价存在,所以Se的含氧化合物以SeO2、SeO3存在,故A错误;
B.Se位于第VIA族,在氢化物中化合价为-2价,所以硒的含氢化合物以H2Se形式存在,故B正确;
C.元素的非金属性越强,其氢化物的稳定性越强,非金属性S>Se,所以硒的氢化物的稳定性比硫化氢差,故C正确;
D.Se和S属于同一主族元素,其最高价氧化物的水化物分子式相同,为H2SeO4,故D正确.
故选A.
点评 本题考查同一主族元素非金属性递变规律,为高考高频点,明确同一主族元素化合价、相同类型化合物结构特点等元素周期律即可解答,题目难度不大.

练习册系列答案
相关题目
10.下列各组离子,能在溶液中大量共存的是( )
| A. | NH4+、Na+、OH-、SO42- | B. | NH4+、Mg2+、NO3-、Cl- | ||
| C. | Ba2+、OH-、Cl-、SO42- | D. | Fe2+、H+、Cl-、NO3- |
11.根据热化学方程式:S(s)+O2(g)=SO2(g)△H=-297.23kJ/mol,下列说法中正确的是( )
| A. | S(g)+O2(g)=SO2(g);△H=-Q kJ/mol.Q的值小于297.23 kJ/mol | |
| B. | S(g)+O2(g)=SO2(g);△H=-Q kJ/mol.Q的值大于297.23 kJ/mol | |
| C. | 1mol SO2的键能总和等于1molS和1molO2的键能和 | |
| D. | 1mol SO2的键能总和小于1molS和1molO2的键能和 |
5.和氖原子有相同的电子层结构的微粒是( )
| A. | He | B. | K+ | C. | Cl- | D. | Na+ |
12.下列实验中,不能观察到明显变化的是( )
| A. | 把Cl2通入FeCl2溶液中 | |
| B. | 把一段打磨过的镁带放入少量冷水中 | |
| C. | 把绿豆大的钾投入少量水中 | |
| D. | 把溴水滴加到淀粉KI溶液中 |
8.把4.6g钠投入到95.6g水中,不考虑水的蒸发,所得溶液中溶质的质量分数是( )
| A. | 4.6% | B. | 7.7% | C. | 8.0% | D. | 10% |
9.一定条件下,硝酸铵受热分解的化学方程式为:NH4NO3→HNO3+N2+H2O(未配平),该反应中,被氧化与被还原的氮原子个数之比为( )
| A. | 5:3 | B. | 5:4 | C. | 1:1 | D. | 3:5 |
 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为N2O.
;一种由B、C组成的化合物与AC2互为等电子体,其化学式为N2O.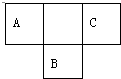 短周期元素的A、B、C在元素周期表中的位置如图所示,已知A、B、C三种元素的原子核外电子数之和等于B的质量数,B原子核内质子数和中子数相等.据此填空:
短周期元素的A、B、C在元素周期表中的位置如图所示,已知A、B、C三种元素的原子核外电子数之和等于B的质量数,B原子核内质子数和中子数相等.据此填空: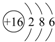
 ,C的单质溶于水所得溶液叫:氢氟酸.
,C的单质溶于水所得溶液叫:氢氟酸.