题目内容
15.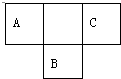 短周期元素的A、B、C在元素周期表中的位置如图所示,已知A、B、C三种元素的原子核外电子数之和等于B的质量数,B原子核内质子数和中子数相等.据此填空:
短周期元素的A、B、C在元素周期表中的位置如图所示,已知A、B、C三种元素的原子核外电子数之和等于B的质量数,B原子核内质子数和中子数相等.据此填空:(1)A的氢化物分子式为:NH3,
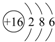
(2)B的元素符号为:S,原子结构示意图为:
(3)C的单质电子式为:
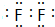 ,C的单质溶于水所得溶液叫:氢氟酸.
,C的单质溶于水所得溶液叫:氢氟酸.
分析 A、B、C为短周期元素,由它们在周期表中的位置,可知A、C处于第二周期,B处于第三周期,令A原子核外电子为x,则B质子数为x+9,C核外电子数为x+2,B原子核内质子数和中子数相等,则B原子质量数为2(x+9),由题意则:x+x+2+x+9=2(x+9),解得x=7,故A为N元素、B为S元素、C为F元素,据此解答.
解答 解:A、B、C为短周期元素,由它们在周期表中的位置,可知A、C处于第二周期,B处于第三周期,令A原子核外电子为x,则B质子数为x+9,C核外电子数为x+2,B原子核内质子数和中子数相等,则B原子质量数为2(x+9),由题意则:x+x+2+x+9=2(x+9),解得x=7,故A为N元素、B为S元素、C为F元素.
(1)由上述分析可知,A为N元素,其氢化物化学式为NH3,故答案为:NH3;
(2)B为S元素,原子核外有3个电子层,各层电子数为2、8、6,原子结构示意图为 ,
,
故答案为:S; ;
;
(3)C的单质为F2,电子式为: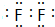 ,氟气溶于水反应生成HF与氧气,所得水溶液叫氢氟酸,
,氟气溶于水反应生成HF与氧气,所得水溶液叫氢氟酸,
故答案为: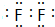 ;氢氟酸.
;氢氟酸.
点评 本题考查原子结构与元素周期表,难度不大,推断元素是解题关键,注意理解同主族元素原子序数关系.

练习册系列答案
相关题目
5.下列各组溶液中,不用任何试剂无法鉴别的是( )
| A. | NaCl、Na2CO3、NaI、AgNO3 | B. | HCl、Na2CO3、新制氯水、NaI | ||
| C. | Na2S、HCl、FeCl3、NaCl | D. | AlCl3、BaCl2、Na2CO3、H2SO4 |
6.除去乙酸乙酯中含有的乙酸,最好的处理和操作是( )
| A. | 蒸馏 | B. | 水洗后分液 | ||
| C. | 用过量饱和碳酸钠溶液洗涤后分液 | D. | 用过量氢氧化钠溶液洗涤后分液 |
3.(1)要除去如表所列物质中的杂质(括号内为杂质),从(I)中选择适宜的试剂,从(II)中选择分离提纯的方法,用序号填入表中.
(Ⅰ)试剂:a.浓硫酸 b.氢氧化钠 c.生石灰 d.水 e.浓溴水
(Ⅱ)方法:A.洗气 B.分液 C.蒸馏
(2)以上采用的操作中,B使用的主要玻璃仪器是分液漏斗、烧杯.
(3)聚氯乙烯是生活中常用的塑料.工业生产聚氯乙烯的一种工艺路线如下:
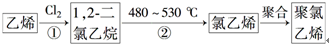
反应①的化学方程式为H2C=CH2+Cl2→CH2ClCH2Cl,反应类型为加成反应,反应②的反应类型为消去反应.
(4)某有机物中各元素的质量分数是:碳49.5%,氢5.20%,氧16.5%,氮28.9%,该有机物的实验式为C4H5ON2.
(Ⅰ)试剂:a.浓硫酸 b.氢氧化钠 c.生石灰 d.水 e.浓溴水
(Ⅱ)方法:A.洗气 B.分液 C.蒸馏
| 要提纯的物质 (杂质) | 乙醇 (水) | 乙炔(H2S) | 溴苯 (溴) |
| 选用试剂 | |||
| 分离方法 | 1 |
(3)聚氯乙烯是生活中常用的塑料.工业生产聚氯乙烯的一种工艺路线如下:
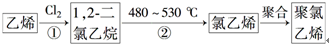
反应①的化学方程式为H2C=CH2+Cl2→CH2ClCH2Cl,反应类型为加成反应,反应②的反应类型为消去反应.
(4)某有机物中各元素的质量分数是:碳49.5%,氢5.20%,氧16.5%,氮28.9%,该有机物的实验式为C4H5ON2.
10.有A、B、C、D、E、F六种元素,已知:①它们位于三个不同短周期,核电荷数依次增大
②B与F同主族.
③B、C分别都能与D按原子个数比1:1或1:2形成化合物.
④A、E分别都能与D按原子个数比1:1或2:1形成化合物.
⑤E元素的电离能数据如表 (kJ•mol-1):
(1)写出只含有A、B、D、E四种元素的两种无水盐的化学式NaHCO3、CH3COONa.
(2)B2A4分子中存在5个σ键,1个π键.
(3)人们通常把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可以用于计算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.下表列出了上述部分元素形成的化学键的键能:
试计算A单质与C单质反应生成CA3时的反应热△H=-90.8kJ•mol-1(要写单位).
②B与F同主族.
③B、C分别都能与D按原子个数比1:1或1:2形成化合物.
④A、E分别都能与D按原子个数比1:1或2:1形成化合物.
⑤E元素的电离能数据如表 (kJ•mol-1):
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
(2)B2A4分子中存在5个σ键,1个π键.
(3)人们通常把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可以用于计算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.下表列出了上述部分元素形成的化学键的键能:
| 化学键 | A-A | C≡C | A-C |
| 键能/kJ•mol-1 | 436.0 | 946 | 390.8 |
20.已知硒是元素周期表中第四周期第ⅥA族元素,关于硒的性质判断肯定不正确的是( )
| A. | 硒的含氧化合物以Se2O3形式存在 | |
| B. | 硒的含氢化合物以H2Se形式存在 | |
| C. | 硒的氢化物的稳定性比硫化氢差 | |
| D. | 硒的最高价氧化物对应水化物的化学式是H2SeO4 |
7.下列各项中表达正确的是( )
| A. | NH3分子的电子式: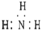 | B. | CH4分子的比例模型: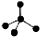 | ||
| C. | O原子的结构示意图: | D. | N2的结构式:N≡N |