题目内容
8.把4.6g钠投入到95.6g水中,不考虑水的蒸发,所得溶液中溶质的质量分数是( )| A. | 4.6% | B. | 7.7% | C. | 8.0% | D. | 10% |
分析 根据钠与水反应生成氢氧化钠和氢气的方程式算出反应后溶质氢氧化钠的质量,再算出氢气质量,再计算出溶液质量,根据计算公式再算出所得溶液的质量分数.
解答 解:设4.6克金属钠与水反应生成氢氧化钠的质量为X,生成氢气质量为Y,
2Na+2H2O═2NaOH+H2↑
46 80 2
4.6g X Y
根据:$\frac{46}{4.6}$=$\frac{80}{X}$=$\frac{2}{Y}$
解得X=8g;Y=0.2g,
反应后所得溶液的质量分数:$\frac{8g}{4.6g+95.6g-0.2g}$×100%=8%.
故选C.
点评 通过回答本题知道了有的物质放入水中溶质已经变了,要根据方程式算出溶质质量再进行计算.

练习册系列答案
相关题目
19.下列物质不能发生加成反应的是( )
| A. | 聚乙炔 | B. | 苯乙烯 | C. | 聚氯乙烯 | D. | 聚1,3-丁二烯 |
20.已知硒是元素周期表中第四周期第ⅥA族元素,关于硒的性质判断肯定不正确的是( )
| A. | 硒的含氧化合物以Se2O3形式存在 | |
| B. | 硒的含氢化合物以H2Se形式存在 | |
| C. | 硒的氢化物的稳定性比硫化氢差 | |
| D. | 硒的最高价氧化物对应水化物的化学式是H2SeO4 |
13.已知有反应2N0+O2═2NO2,今在体积为VL的密闭容器中通入amolNO和bmolO2,反应后容器中氮原子和氧原子个数之比为( )
| A. | $\frac{a}{b}$ | B. | $\frac{a}{2b}$ | C. | $\frac{a}{a+2b}$ | D. | $\frac{a}{2a+2b}$ |
20.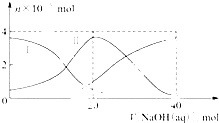 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关粒子的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关粒子的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是( )
 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关粒子的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关粒子的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是( )| A. | 当V[NaOH(aq)]=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| B. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 | |
| C. | H2A第一步电离的方程式为H2A=HA-+H+ | |
| D. | 向NaHA溶液加入水稀释的过程中,pH可能增大也可能减小 |
17.某纯净物由两种原子构成,则该物质( )
| A. | 一定是化合物 | B. | 一定是单质 | ||
| C. | 可能是化合物,也可能是单质 | D. | 一定是同素异形体 |
18.下列关于钠原子和钠离子的叙述正确的是( )
| A. | 钠离子比钠原子少了一个质子 | |
| B. | 钠原子有还原性,钠离子有氧化性 | |
| C. | 钠原子和钠离子有相似的化学性质 | |
| D. | 钠原子不稳定,钠离子稳定,两者具有相同的电子层数 |