题目内容
10.下列各组离子,能在溶液中大量共存的是( )| A. | NH4+、Na+、OH-、SO42- | B. | NH4+、Mg2+、NO3-、Cl- | ||
| C. | Ba2+、OH-、Cl-、SO42- | D. | Fe2+、H+、Cl-、NO3- |
分析 根据离子之间不能结合生成水、气体、沉淀,或不发生氧化还原反应、互促水解等反应,则离子能大量共存,以此来解答.
解答 解:A.NH4+、OH-反应生成一水合氨而不能大量共存,故A错误;
B.离子之间不发生反应,可大量共存,故B正确;
C.Ba2+、SO42-反应生成沉淀而不能大量共存,故C错误;
D.Fe2+、H+、NO3-发生氧化还原反应,不能大量共存,故D错误.
故选B.
点评 本题考查离子的共存,为高考常见题型,侧重于学生的分析能力的考查,明确复分解反应发生以及氧化还原反应即可解答,题目较简单,注重基础知识的考查.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案
相关题目
20.下列仪器的使用或操作正确的是( )
| A. | 分液漏斗中液体的总体积不得超过其容量的2/3 | |
| B. | 萃取时,用右手压住分液漏斗的玻璃塞,左手握住旋塞,将分液漏斗倒过来用力震荡 | |
| C. | 分液漏斗的检漏只需检查旋塞处是否漏水即可 | |
| D. | 课本中测定中和热实验的装置,用铜制环形搅棒代替玻璃环形搅棒更耐用 |
1.某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下.试根据下表中的实验现象回答下列问题:
(1)实验1、4、5中负极分别是Mg、Al、Zn;
(2)写出实验3中的正极反应式2H++2e-═H2↑.
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Al、Mg | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、石墨 | 稀盐酸 | 偏向石墨 |
| 4 | Al、Mg | 氢氧化钠 | 偏向Mg |
| 5 | Al、Zn | 稀盐酸 | 偏向Al |
(2)写出实验3中的正极反应式2H++2e-═H2↑.
5.下列各组溶液中,不用任何试剂无法鉴别的是( )
| A. | NaCl、Na2CO3、NaI、AgNO3 | B. | HCl、Na2CO3、新制氯水、NaI | ||
| C. | Na2S、HCl、FeCl3、NaCl | D. | AlCl3、BaCl2、Na2CO3、H2SO4 |
15.几种短周期元素的原子半径及主要化合价如下表:下列叙述正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | X元素的单质常用于炼铁 | |
| B. | 一定条件下,Z单质与W的常见单质直接化合生成酸性氧化物 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 一定条件下,W单质可以将Z单质从其氢化物中置换出来 |
2.下列卤代烃,在一定条件下,能发生消去反应且产物只有一种的是( )
| A. | CH3Cl | B. | CH3-CHBr-CH3 | C. | 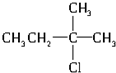 | D. | 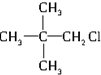 |
19.下列物质不能发生加成反应的是( )
| A. | 聚乙炔 | B. | 苯乙烯 | C. | 聚氯乙烯 | D. | 聚1,3-丁二烯 |
20.已知硒是元素周期表中第四周期第ⅥA族元素,关于硒的性质判断肯定不正确的是( )
| A. | 硒的含氧化合物以Se2O3形式存在 | |
| B. | 硒的含氢化合物以H2Se形式存在 | |
| C. | 硒的氢化物的稳定性比硫化氢差 | |
| D. | 硒的最高价氧化物对应水化物的化学式是H2SeO4 |