题目内容
11.根据热化学方程式:S(s)+O2(g)=SO2(g)△H=-297.23kJ/mol,下列说法中正确的是( )| A. | S(g)+O2(g)=SO2(g);△H=-Q kJ/mol.Q的值小于297.23 kJ/mol | |
| B. | S(g)+O2(g)=SO2(g);△H=-Q kJ/mol.Q的值大于297.23 kJ/mol | |
| C. | 1mol SO2的键能总和等于1molS和1molO2的键能和 | |
| D. | 1mol SO2的键能总和小于1molS和1molO2的键能和 |
分析 物质由固态转变成气态要吸收热量,放热反应中旧键断裂吸收的能量小于新键形成所放出的能量.
解答 解:A、因物质由固态转变成气态也要吸收热量,所以S(g)+O2(g)=SO2(g)的反应放出的热量的数值大于297.23kJ•mol-1,故A错误;
B、因物质由固态转变成气态也要吸收热量,所以S(g)+O2(g)=SO2(g)的反应放出的热量的数值大于297.23kJ•mol-1,故B正确;
C、为放热反应,则1molSO2的键能总和大于1molS和1molO2的键能总和,故C错误;
D、为放热反应,则1molSO2的键能总和大于1molS和1molO2的键能总和,故D错误;
故选B.
点评 本题主要考查了化学反应中反应热的计算,需要注意的是物质三态之间的转变也存在能量的变化.

练习册系列答案
相关题目
1.某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下.试根据下表中的实验现象回答下列问题:
(1)实验1、4、5中负极分别是Mg、Al、Zn;
(2)写出实验3中的正极反应式2H++2e-═H2↑.
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Al、Mg | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、石墨 | 稀盐酸 | 偏向石墨 |
| 4 | Al、Mg | 氢氧化钠 | 偏向Mg |
| 5 | Al、Zn | 稀盐酸 | 偏向Al |
(2)写出实验3中的正极反应式2H++2e-═H2↑.
2.下列卤代烃,在一定条件下,能发生消去反应且产物只有一种的是( )
| A. | CH3Cl | B. | CH3-CHBr-CH3 | C. | 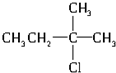 | D. | 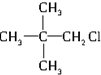 |
19.下列物质不能发生加成反应的是( )
| A. | 聚乙炔 | B. | 苯乙烯 | C. | 聚氯乙烯 | D. | 聚1,3-丁二烯 |
6.除去乙酸乙酯中含有的乙酸,最好的处理和操作是( )
| A. | 蒸馏 | B. | 水洗后分液 | ||
| C. | 用过量饱和碳酸钠溶液洗涤后分液 | D. | 用过量氢氧化钠溶液洗涤后分液 |
16.下列数据是有机物的相对分子质量,可能互为同系物的一组是( )
| A. | 16、30、58、72 | B. | 16、28、40、52 | C. | 16、32、48、54 | D. | 16、30、42、56 |
3.(1)要除去如表所列物质中的杂质(括号内为杂质),从(I)中选择适宜的试剂,从(II)中选择分离提纯的方法,用序号填入表中.
(Ⅰ)试剂:a.浓硫酸 b.氢氧化钠 c.生石灰 d.水 e.浓溴水
(Ⅱ)方法:A.洗气 B.分液 C.蒸馏
(2)以上采用的操作中,B使用的主要玻璃仪器是分液漏斗、烧杯.
(3)聚氯乙烯是生活中常用的塑料.工业生产聚氯乙烯的一种工艺路线如下:
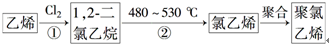
反应①的化学方程式为H2C=CH2+Cl2→CH2ClCH2Cl,反应类型为加成反应,反应②的反应类型为消去反应.
(4)某有机物中各元素的质量分数是:碳49.5%,氢5.20%,氧16.5%,氮28.9%,该有机物的实验式为C4H5ON2.
(Ⅰ)试剂:a.浓硫酸 b.氢氧化钠 c.生石灰 d.水 e.浓溴水
(Ⅱ)方法:A.洗气 B.分液 C.蒸馏
| 要提纯的物质 (杂质) | 乙醇 (水) | 乙炔(H2S) | 溴苯 (溴) |
| 选用试剂 | |||
| 分离方法 | 1 |
(3)聚氯乙烯是生活中常用的塑料.工业生产聚氯乙烯的一种工艺路线如下:
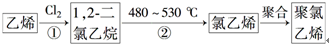
反应①的化学方程式为H2C=CH2+Cl2→CH2ClCH2Cl,反应类型为加成反应,反应②的反应类型为消去反应.
(4)某有机物中各元素的质量分数是:碳49.5%,氢5.20%,氧16.5%,氮28.9%,该有机物的实验式为C4H5ON2.
20.已知硒是元素周期表中第四周期第ⅥA族元素,关于硒的性质判断肯定不正确的是( )
| A. | 硒的含氧化合物以Se2O3形式存在 | |
| B. | 硒的含氢化合物以H2Se形式存在 | |
| C. | 硒的氢化物的稳定性比硫化氢差 | |
| D. | 硒的最高价氧化物对应水化物的化学式是H2SeO4 |
20. 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关粒子的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关粒子的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是( )
 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关粒子的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关粒子的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是( )| A. | 当V[NaOH(aq)]=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| B. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 | |
| C. | H2A第一步电离的方程式为H2A=HA-+H+ | |
| D. | 向NaHA溶液加入水稀释的过程中,pH可能增大也可能减小 |