题目内容
9.一定条件下,硝酸铵受热分解的化学方程式为:NH4NO3→HNO3+N2+H2O(未配平),该反应中,被氧化与被还原的氮原子个数之比为( )| A. | 5:3 | B. | 5:4 | C. | 1:1 | D. | 3:5 |
分析 NH4NO3→HNO3+N2+H2O中只有N元素的化合价变化,N元素化合价由铵根离子中-3价升高为氮气中0价,由硝酸根中+5价降低氮气为0价,结合电子转移守恒计算反应中被氧化与被还原的氮原子数之比.
解答 解:反应中只有N元素的化合价变化,N元素化合价由铵根离子中-3价升高为氮气中0价,被氧化;由硝酸根中+5价降低氮气为0价,被还原.
由电子转移守恒可知,反应中被氧化与被还原的氮原子数之比为(5-0):[0-(-3)]=5:3,
故选A.
点评 本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化及电子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
20.已知硒是元素周期表中第四周期第ⅥA族元素,关于硒的性质判断肯定不正确的是( )
| A. | 硒的含氧化合物以Se2O3形式存在 | |
| B. | 硒的含氢化合物以H2Se形式存在 | |
| C. | 硒的氢化物的稳定性比硫化氢差 | |
| D. | 硒的最高价氧化物对应水化物的化学式是H2SeO4 |
20. 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关粒子的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关粒子的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是( )
 常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关粒子的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是( )
常温下,向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液.有关粒子的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是( )| A. | 当V[NaOH(aq)]=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| B. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 | |
| C. | H2A第一步电离的方程式为H2A=HA-+H+ | |
| D. | 向NaHA溶液加入水稀释的过程中,pH可能增大也可能减小 |
17.某纯净物由两种原子构成,则该物质( )
| A. | 一定是化合物 | B. | 一定是单质 | ||
| C. | 可能是化合物,也可能是单质 | D. | 一定是同素异形体 |
14.下列离子方程式书写正确的是( )
| A. | 硫化亚铁与盐酸反应:S2-+2H+═H2S↑ | |
| B. | SO2通入溴水中:SO2+Br2+2H2O═SO42-+2Br-+4H+ | |
| C. | 硫酸与氢氧化钡溶液混合:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | SO2通入氯化钙溶液中:SO2+Ca2++H2O═CaSO3↓+2H+ |
18.下列关于钠原子和钠离子的叙述正确的是( )
| A. | 钠离子比钠原子少了一个质子 | |
| B. | 钠原子有还原性,钠离子有氧化性 | |
| C. | 钠原子和钠离子有相似的化学性质 | |
| D. | 钠原子不稳定,钠离子稳定,两者具有相同的电子层数 |
19.一定条件下,体积为1L的密闭容器中发生如下反应:SiF4(g)+2H2O(g)?SiO2(s)+4HF(g)△H=+148.9kJ•mol-1
(1)下列各项中能说明该反应已达化学平衡状态的是bcd(填字母序号).
a.v消耗(SiF4)=4v生成(HF)
b.容器内气体压强不再变化
c.容器内气体的总质量不再变化
d.HF的体积分数不再变化
(2)反应过程中测定的部分数据如下表(表中t2>t1)所示.
通过a或b的值及化学平衡原理说明t1时反应是否达到化学平衡状态:t1时反应已经达到化学平衡状态.
(3)若只改变一个条件使上述反应的化学平衡常数变大,该反应ade(填序号).
a.一定向正反应方向移动
b.一定向逆反应方向移动
c.一定是减小压强造成的
d.一定是升高温度造成的
e.SiF4的平衡转化率一定增大.
(1)下列各项中能说明该反应已达化学平衡状态的是bcd(填字母序号).
a.v消耗(SiF4)=4v生成(HF)
b.容器内气体压强不再变化
c.容器内气体的总质量不再变化
d.HF的体积分数不再变化
(2)反应过程中测定的部分数据如下表(表中t2>t1)所示.
| 反应时间/min | n(SiF4)/mol | n(H2O)/mol |
| 0 | 1.20 | 2.40 |
| t1 | 0.80 | a |
| t2 | b | 1.60 |
(3)若只改变一个条件使上述反应的化学平衡常数变大,该反应ade(填序号).
a.一定向正反应方向移动
b.一定向逆反应方向移动
c.一定是减小压强造成的
d.一定是升高温度造成的
e.SiF4的平衡转化率一定增大.

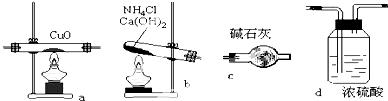 实验室用氨气在加热下还原氧化铜的方法铜的相对原子质量如果选用测定反应物氧化铜和生成物水的质量[m(CO)、m(H2O)]时,如图所示请用下列仪器设计一个简单实验方案.
实验室用氨气在加热下还原氧化铜的方法铜的相对原子质量如果选用测定反应物氧化铜和生成物水的质量[m(CO)、m(H2O)]时,如图所示请用下列仪器设计一个简单实验方案.