题目内容
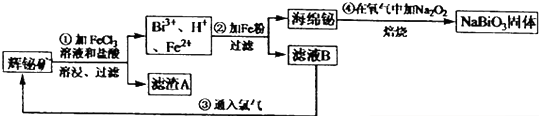
13.向一定量的Cu、Fe2O3、的混合物中加入300mL 1mol/L的盐酸,恰好使混合物完全溶解,所得溶液中不含Fe3+原混合物中Cu的质量为( )| A. | 9.6g | B. | 6.4g | C. | 3.2g | D. | 1.6g |
分析 Cu、Fe2O3的混合物中加入300mL 1mol•L-1的盐酸溶液,恰好使混合物完全溶解,所得溶液中不含Fe3+,溶液中溶质为氯化铜、氯化亚铁,该反应过程为:盐酸与氧化铁恰好反应,生成氯化铁与水,生成的氯化铁与铜恰好反应转化为氯化铜、氯化亚铁;
由水的分子式H2O可知,氧化物中2n(O)=n(HCl),据此可以计算出氧化铁的物质的量,再根据铜与氧化铁的反应关系式得出铜的物质的量,最后根据m=nM计算出铜的质量.
解答 解:Cu、Fe2O3的混合物中加入300mL 1mol•L-1的盐酸溶液,恰好使混合物完全溶解,所得溶液中不含Fe3+,溶液中溶质为氯化铜、氯化亚铁,该反应过程为:盐酸与氧化铁恰好反应生成氯化铁与水、生成的氯化铁与铜恰好反应转化为氯化铜、氯化亚铁,
由水的分子式H2O可知,氧化物中2n(O)=n(HCl)=0.3L×1mol/L=0.3mol,故n(O)=0.15mol,
则混合物中氧化铁的物质的量为:n(Fe2O3)=$\frac{1}{3}$n(O)=0.05mol,
根据铜与氧化铁的反应关系式Cu~Fe2O3可知,Cu的物质的量为0.05mol,质量为64g/mol×0.05mol=3.2g,
故选C.
点评 本题考查氧化还原反应的计算,题目难度中等,明确发生反应原理为解答关键,注意掌握守恒思想在化学计算中的应用,试题侧重考查学生的分析、理解能力及化学计算能力.

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
16.两种元素原子的核外电子层数之比与最外层电子数之比相等,则在核电荷数为1~18元素中,满足上述关系的元素共有( )
| A. | 3对 | B. | 4对 | C. | 5对 | D. | 6对 |
1.甲烷在隔绝空气加强热时可分解为C2H2和H2,若有80%CH4按上述形式分解,所得混合气体的密度是相同条件下氢气密度的倍数是( )
| A. | 2 | B. | 2.22 | C. | 3.46 | D. | 4.44 |
5.只有在化合物中才能存在的化学键是( )
①离子键 ②氢键 ③共价键 ④极性键 ⑤非极性键.
①离子键 ②氢键 ③共价键 ④极性键 ⑤非极性键.
| A. | ①④ | B. | ①②④ | C. | ③⑤ | D. | ①③⑤ |
3.下列叙述正确的是( )
| A. | 在某反应中,当反应物具有的总能量大于生成物具有的总能量时,该反应吸热 | |
| B. | 同温同压下,4Al(s)+3O2(g)═2Al2O3(s)在常温和点燃条件下的△H不同 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)═H2O(l);△H=-53.7KJ/mol,若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量大于53.7kJ | |
| D. | 需要加热的化学反应一定是吸热反应 |
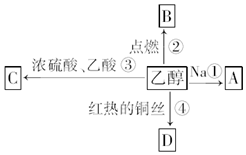 乙醇是生活中常见的有机物,能进行如图所示的多种反应,A、B、C、D都是有机物.
乙醇是生活中常见的有机物,能进行如图所示的多种反应,A、B、C、D都是有机物.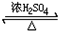 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O