题目内容
8.A、B、C、D均为中学化学常见的纯净物,它们之间有如下的反应关系(反应物中的水没标出):A+B→C+D.(1)若上述反应是工业制玻璃的主要反应之一,B为氧化物,则B的化学式为SiO2,B常被用来制造光导纤维,可用于通讯、能量传输、信息处理等.
(2)若A为短周期的金属单质,D为气态单质,B溶液呈强酸性或强碱性时,该反应都能进行,请写出反应的离子方程式2Al+6H+=2Al3++3H2↑;2Al+2H2O+2OH-=2AlO2-+3H2↑.
(3)常温下,若A为黄绿色气体,A、B均能使品红溶液褪色,相对分子质量C>D,则A与B在水溶液中反应化学方程式为Cl2+SO2+2H2O=2HCl+H2SO4;检验D中阴离子的试剂是硝酸银溶液和稀硝酸.
(4)已知含有(2)中A物质元素的一种新型无机高分子材料是高效净水剂[AFe(OH)4Cl2]m.该无机高分子材料与过量的(3)中D物质浓溶液可以反应,请写出该反应的化学方程式:[AlFe(OH)4Cl2]m+4m HCl=m AlCl3+m FeCl3+4m H2O.
分析 (1)反应是工业制玻璃的主要反应之一,而工业上用二氧化硅和碳酸盐反应来生产玻璃,B为氧化物,则B为二氧化硅,二氧化硅用作光导纤维;
(2)若A为短周期的金属单质,D为气态单质,B溶液呈酸性或强碱性时,该反应都能进行,则A为Al,D为H2;
(3)常温下,若A为黄绿色气体,A、B均能使品红溶液褪色,相对分子质量C>D,则A为Cl2,B为SO2,C为H2SO4,D为HCl;氯离子的检验用硝酸银溶液;
(4)[AlFe(OH)4Cl2]m与足量的盐酸反应生成氯化铝、氯化铁与水.
解答 解:(1)反应是工业制玻璃的主要反应之一,而工业上用二氧化硅和碳酸盐反应来生产玻璃,B为氧化物,则B为SiO2,二氧化硅用作光导纤维,可用于通讯、能量传输、信息处理等,
故答案为:SiO2;光导纤维;
(2)若A为短周期的金属单质,D为气态单质,B溶液呈酸性或强碱性时,该反应都能进行,则A为Al,D为H2,反应离子方程式为:2Al+6H+=2Al3++3H2↑;2Al+2H2O+2OH-=2AlO2-+3H2↑,
故答案为:2Al+6H+=2Al3++3H2↑;2Al+2H2O+2OH-=2AlO2-+3H2↑;
(3)常温下,若A为黄绿色气体,A、B均能使品红溶液褪色,相对分子质量C>D,则A为Cl2,B为SO2,C为H2SO4,D为HCl,A与B在水溶液中反应方程式为:Cl2+SO2+2H2O=2HCl+H2SO4,氯离子的检验:加入硝酸酸化的硝酸银,如果产生白色沉淀,证明含有氯离子,反之则没有,
故答案为:Cl2+SO2+2H2O=2HCl+H2SO4;硝酸银溶液和稀硝酸;
(4)[AlFe(OH)4Cl2]m与足量的盐酸反应生成氯化铝与水,反应方程式为:[AlFe(OH)4Cl2]m+4m HCl=m AlCl3+m FeCl3+4m H2O,
故答案为:[AlFe(OH)4Cl2]m+4m HCl=m AlCl3+m FeCl3+4m H2O.
点评 本题考查无机物推断,主要考查氯气、硫及其化合物、铝及其化合物等物质性质的推断和运用,需要学生熟练掌握元素化合物性质与转化,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 Hg是水体污染的重金属元素之一.水溶液中二价汞的主要存在形态与C1-、OH-的浓度关系如图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-lgc(Cl-)].下列说法不正确的是( )
Hg是水体污染的重金属元素之一.水溶液中二价汞的主要存在形态与C1-、OH-的浓度关系如图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-lgc(Cl-)].下列说法不正确的是( )| A. | 可用如下方法除去污水中的Hg2+:FeS(s)+Hg2+(aq)=HgS(s)+Fe2+(aq) | |
| B. | 当溶液pCl保持在1,pH在6~8时,汞元素主要以HgCl42-形式存在 | |
| C. | HgCl2是一种强电解质,其电离方程式是:HgCl2=HgCl++Cl- | |
| D. | 当溶液pH保持在5,pCl由2改变至6时.可使HgCl2转化为Hg(OH)2 |
| A. | 2.24L | B. | 1.12L | C. | 0.672L | D. | 0.448L |
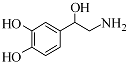
| A. | 每个去甲肾上腺素分子中含有3个酚羟基 | |
| B. | 每个去甲肾上腺素分子中含有2个手性碳原子 | |
| C. | 1mol去甲肾上腺素最多能与2molBr2发生取代反应 | |
| D. | 去甲肾上腺素既能与盐酸反应,又能与氢氧化钠溶液反应 |
| A. | 9.6g | B. | 6.4g | C. | 3.2g | D. | 1.6g |
| A. | 丙烯与氯化氢加成 | B. | 2-溴丙烷与NaOH醇溶液共热 | ||
| C. | 1-溴丁烷与NaOH醇溶液共热 | D. | 1-溴丙烷与NaOH溶液共热 |
| A. | Fe2+、Mg2+、Al3+ | B. | Mg2+、Al3+、Cu2+ | C. | Fe3+、Cu2+、Zn2+ | D. | Ag+、Cu2+、Zn2+ |
 完成下列空白.
完成下列空白.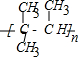 ;
; +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O.
+3H2O.