题目内容
1.甲烷在隔绝空气加强热时可分解为C2H2和H2,若有80%CH4按上述形式分解,所得混合气体的密度是相同条件下氢气密度的倍数是( )| A. | 2 | B. | 2.22 | C. | 3.46 | D. | 4.44 |
分析 甲烷的物质的量为1mol,根据方程式计算反应后混合气体的总的物质的量,根据质量守恒可知,反应后混合气体的质量等于起始甲烷的质量,根据m=nM计算开始甲烷的质量,再根据M=$\frac{m}{n}$计算混合气体的平均摩尔质量,相同条件下密度之比等于摩尔质量之比,据此计算判断.
解答 解:令甲烷的物质的量为1mol,分解的甲烷为0.8mol,则:
2CH4→C2H2+3H2 气体物质的量增大
2 2
0.8mol 0.8mol
故反应后气体的总的物质的量为1mol+0.8mol=1.8mol,
故反应后混合气体的平均摩尔质量=$\frac{1mol×16g/mol}{1.8mol}$=$\frac{16}{1.8}$g/mol,
所得混合气体的密度是相同条件下氦气密度的倍数为$\frac{\frac{16}{1.8}}{4}$=2.22,
故选B.
点评 本题考查混合物的有关计算,难度不大,计算混合气体的平均摩尔质量是关键,注意相同条件下密度之比等于摩尔质量之比.

练习册系列答案
相关题目
4.下列实验装置和试剂的选用或操作都正确的是( )
| A. | 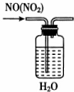 除去NO中的NO2 | B. | 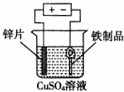 铁制品表面镀锌 | C. | 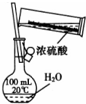 稀释浓硫酸 | D. | 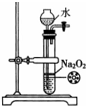 制备少量O2 |
12.既能用浓硫酸,又能用碱石灰干燥的气体是( )
| A. | Cl2 | B. | SO2 | C. | N2 | D. | NH3 |
9.下列各式表示水解反应的是( )
| A. | HCO3-+H2O?H3O++CO32- | B. | HS-+H2O?H2S+OH- | ||
| C. | H2PO4-+H2O?HPO42-+H3O+ | D. | HCO3-+OH-?H2O+CO32- |
16.有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3物质的量浓度分别是4mol/L和2mol/L,取10mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的气体为( )
| A. | 2.24L | B. | 1.12L | C. | 0.672L | D. | 0.448L |
6.同分异构体现象在有机化学中是非常普遍的,下列有机物互为同分异构体的是( )
①CH2=CHCH3② ③CH3CH2CH3 ④HC≡CCH3 ⑤
③CH3CH2CH3 ④HC≡CCH3 ⑤ ⑥CH3CH=CHCH3.
⑥CH3CH=CHCH3.
①CH2=CHCH3②
 ③CH3CH2CH3 ④HC≡CCH3 ⑤
③CH3CH2CH3 ④HC≡CCH3 ⑤ ⑥CH3CH=CHCH3.
⑥CH3CH=CHCH3.| A. | ①和② | B. | ①和③ | C. | ①和④ | D. | ④和⑥ |
13.向一定量的Cu、Fe2O3、的混合物中加入300mL 1mol/L的盐酸,恰好使混合物完全溶解,所得溶液中不含Fe3+原混合物中Cu的质量为( )
| A. | 9.6g | B. | 6.4g | C. | 3.2g | D. | 1.6g |
10.SF6是一种优良的绝缘气体,分子结构中只存在S-F键.已知断裂lmol F-F、S-F键需吸收的能量分别为l60kJ、330kJ.又知:1mol S(s)转化成气态S原子时吸收280kJ能量,则S(s)+3F2(g)═SF6(g)的反应热为( )
| A. | -770 kJ/mol | B. | -l220 kJ/mol | C. | -1500kJ/mol | D. | -2740kJ/mol |
11.下列叙述正确的是( )
| A. | 常温下1L0.1mol/LNH4Cl溶液与2L0.05mol/LNH4Cl溶液中c(NH4+)相等 | |
| B. | pH=5的CH3COOH溶液和pH=5的NH4NO3溶液中,c(H+)相等 | |
| C. | pH=6的CH3COOH和CH3COONa混合液中:c(Na+)+c(OH-)-c(CH3COO-)=10-6mol/L | |
| D. | pH=9的NaHA溶液中:c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-)>c(H+) |