题目内容
4.铋酸钠(NaBi03)常用作Mn2十鉴定的强氧化剂.某研究小组用浮选过的辉铋矿(主要成分是Bi2S3,还含少量Bi203,SiO2等杂质)制备铋酸钠,其流程如下: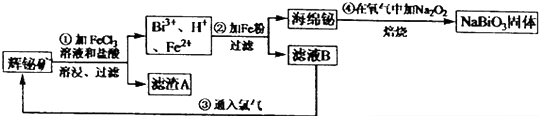
己知:
①铋酸钠是一种难溶于水的物质;
②BiC13极易水解生成不溶性的BiOCl沉淀,在浓盐酸中几乎不水解;FeC13溶液开始沉淀的pH值为2.7,沉淀完全时的pH值为3.7.
请回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,可以采取的措施bcd(选滨字母序号).
a.加入足量的蒸馏水 b.拢拌 e.粉碎矿石 d.升离温度
(2)溶浸时通常加入FeC13溶掖和浓盐徽,向其中加入过量浓盐酸的目的是防止FeCl3及BiCl3水解生成不溶性沉淀,提高原料的浸出率.滤渣A的主要成分为SiO2、S
(3)铋酸钠可在酸性介质中将Mn2+氧化为Mn04一,故可用于M2+的鉴定.已知NaBi03被还原为Bi3+试写出该反应的离子方程式:5NaBiO3+2Mn2++14H+=2MnO4-+5Na++5Bi3++7H2O
(4)实验室为了测定NaBi03样品的纯度,需要配制250mL 2.0mo1•L-1,FeSO4溶液,所需要的玻瑞仪器除烧杯、量筒、玻璃棒外,还需要250mL容量瓶、胶头滴管配制2.0mo1•L-1FeSO4溶液定容时具体的操作步获为沿着玻璃棒向容量瓶中加入蒸馏水至离刻度线1~2cm处,再改用胶头滴管滴加蒸馏水至溶液凹液面与刻度线相切
(5)取上述NaBi03样品10.0g,加入稀硫酸和MnSO4溶液使其完全溶解,然后用新配制的2.0mo1•L-1FesO4;溶液对生成的Mn04一进行滴定,滴定完成后稍耗31.00mL FeS04溶液.则该样品中NaBi03纯度为86.8%.
分析 辉铋矿(主要成分是Bi2S3.还含少量Bi203,SiO2等杂质)制备铋酸钠,辉铋矿加入氯化铁溶液和盐酸溶解后过滤,氯化铁氧化硫离子为硫单质,盐酸是防止FeCl3及BiCl3水解生成不溶性沉淀,得到滤渣为SiO2和S,滤液中含有Bi3+,H+,Fe2+,滤液中加入铁粉过滤得到海绵铋,和滤液B主要是氯化亚铁,通入氯气后生成氯化铁,然后循环使用,海绵铋在氧气中加入过氧化钠发生氧化还原反应生成NaBiO3;
(1)提高溶浸工序中原料的浸出率,可以结合影响化学反应速率的因素分析;
(2)加入过量浓盐酸的目的是防止FeCl3及BiCl3水解生成不溶性沉淀,上述分析可知滤渣为二氧化硅和氯化铁氧化生成的硫单质;
(3)铋酸钠可在酸性介质中将Mn2+氧化为Mn04-,NaBi03被还原为Bi3+,依据电荷守恒和原子守恒书写反应的离子方程式:
(4)配制溶液步骤和过程分析需要的玻璃仪器,烧杯中溶解后,转移到容量瓶,加水至刻度定容;
(5)依据化学反应的定量关系计算,5NaBiO3~2MnO4 -~10Fe2+,得到NaBiO3物质的量,得到质量计算质量分数.
解答 解:辉铋矿(主要成分是Bi2S3.还含少量Bi203,SiO2等杂质)制备铋酸钠,辉铋矿加入氯化铁溶液和盐酸溶解后过滤,氯化铁氧化硫离子为硫单质,盐酸是防止FeCl3及BiCl3水解生成不溶性沉淀,得到滤渣为SiO2和S,滤液中含有Bi3+,H+,Fe2+,滤液中加入铁粉过滤得到海绵铋,和滤液B主要是氯化亚铁,通入氯气后生成氯化铁,然后循环使用,海绵铋在氧气中加入过氧化钠发生氧化还原反应生成NaBiO3;
(1)a.加入足量的蒸馏水不能溶解矿石中的物质,不能提高浸出率,故a错误;
b.拢拌加快物质溶解,能提高浸出率,故b正确;
e.粉碎矿石增大接触面积,提高反应速率,故c正确;
d.升离温度提高反应速率,可以提高溶浸工序中原料的浸出率,故d正确,
故答案为:bcd;
(2)加入过量浓盐酸的目的是防止FeCl3及BiCl3水解生成不溶性沉淀,上述分析可知滤渣为二氧化硅和氯化铁氧化生成的硫单质,
故答案为:防止FeCl3及BiCl3水解生成不溶性沉淀,提高原料的浸出率;SiO2、S;
(3)铋酸钠可在酸性介质中将Mn2+氧化为Mn04-,NaBi03被还原为Bi3+,由电荷守恒和原子守恒可知反应的离子方程式为5NaBiO3+2Mn2++14H+=2MnO4-+5Na++5Bi3++7H2O,
故答案为:5NaBiO3+2Mn2++14H+=2MnO4-+5Na++5Bi3++7H2O;
(4)配制溶液步骤和过程分析需要的玻璃仪器,所需要的玻瑞仪器除烧杯、量筒、玻璃棒外,还需要250mL容量瓶、胶头滴管,配制2.0mo1•L-1FeSO4溶液定容时具体的操作步骤为,硫酸亚铁在烧杯中溶解后,转移到容量瓶,加水至刻度定容,具体步骤为:沿着玻璃棒向容量瓶中加入蒸馏水至离刻度线1~2cm处,再改用胶头滴管滴加蒸馏水至溶液凹液面与刻度线相切,
故答案为:沿着玻璃棒向容量瓶中加入蒸馏水至离刻度线1~2cm处,再改用胶头滴管滴加蒸馏水至溶液凹液面与刻度线相切;
(5)由5NaBiO3+2Mn2++14H+=2MnO4-+5Na++5Bi3++7H2O、MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O可知,
5NaBiO3~2MnO4 -~10Fe2+,
5 10
n(NaBiO3) 2.0mo1•L-1×0.0310L
n(NaBiO3)=0.031mol
得到质量计算质量分数=$\frac{0.031mol×280g/mol}{10.0g}$×100%=86.8%,
故答案为:86.8%.
点评 本题考查了物质分离提纯的方法和过程分析判断,实验基本操作,溶液配制方法的分析应用,注意物质性质的理解应用,掌握基础是关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| X | Y | ||
| M | Z |
| A. | 简单氢化物稳定性:X>Z | B. | 简单离子半径:Y<M | ||
| C. | 最高价氧化物水化物的酸性:X<Z | D. | 得电子能力:X>Y |
| A. | Cl2 | B. | SO2 | C. | N2 | D. | NH3 |
| A. | HCO3-+H2O?H3O++CO32- | B. | HS-+H2O?H2S+OH- | ||
| C. | H2PO4-+H2O?HPO42-+H3O+ | D. | HCO3-+OH-?H2O+CO32- |
| A. | 2.24L | B. | 1.12L | C. | 0.672L | D. | 0.448L |
| A. | 9.6g | B. | 6.4g | C. | 3.2g | D. | 1.6g |
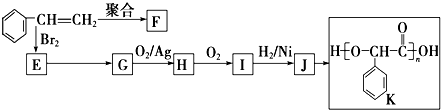
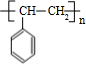 ;I的分子式是C8H6O3.
;I的分子式是C8H6O3.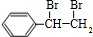 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$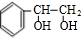 +2NaBr;反应类型属于水解反应.
+2NaBr;反应类型属于水解反应.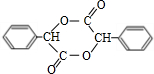 .
.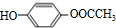 或
或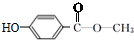 .
.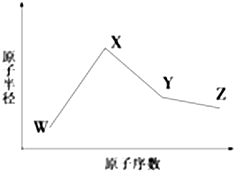 W、X、Y、Z、M、N是六种常见的短周期元素,其中W、X、Y、Z原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.M的原子序数比Y小1,N元素最高化合价是最低化合价绝对值的3倍.
W、X、Y、Z、M、N是六种常见的短周期元素,其中W、X、Y、Z原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.M的原子序数比Y小1,N元素最高化合价是最低化合价绝对值的3倍.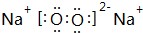 ,
,