题目内容
16.两种元素原子的核外电子层数之比与最外层电子数之比相等,则在核电荷数为1~18元素中,满足上述关系的元素共有( )| A. | 3对 | B. | 4对 | C. | 5对 | D. | 6对 |
分析 短周期元素中,两种元素原子的核外电子层数之比情况:1:1;1:2;1:3;2:3.据此确定最外层电子数.进而确定元素组合.短周期元素中满足元素原子的核外电子层数之比与最外层电子数之比相等有H、Be;He、C;H、Al;He、S;Be、Al;C、S.以此来分析.
解答 解:短周期元素中,两种元素原子的核外电子层数之比情况为1:1、1:2、1:3、2:3,
若电子层数之比为1:1,则两元素处于同一周期,不存在;
若电子层数之比为1:2,则两元素分别处于第一、第二周期,当最外层电子数分别为1、2时,对应元素为H、Be;当最外层电子数分别为2、4时,对应元素为He、C;当最外层电子数分别为3、6时,不存在;
若电子层数之比为1:3,则两元素分别处于第一、第三周期,当最外层电子数分别为1、3时,对应元素为H、Al;当最外层电子数分别为2、6时,对应元素为He、S;
若电子层数之比为2:3,则两元素分别处于第二、第三周期,当最外层电子数分别为2、3时,对应元素为Be、Al;当最外层电子数分别为4、6时,对应元素为C、S.
故满足条件组合有:H、Be;He、C;H、Al;He、S;Be、Al;C、S.
故选D.
点评 本题考查原子结构,明确原子的电子层数与最外层电子数是解答本题的关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下表是元素周期表的一部分,Y原子最外层电子数是次外层电子数的3倍,下列说法正确的是( )
| X | Y | ||
| M | Z |
| A. | 简单氢化物稳定性:X>Z | B. | 简单离子半径:Y<M | ||
| C. | 最高价氧化物水化物的酸性:X<Z | D. | 得电子能力:X>Y |
4.下列实验装置和试剂的选用或操作都正确的是( )
| A. | 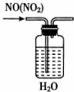 除去NO中的NO2 | B. | 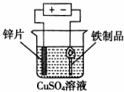 铁制品表面镀锌 | C. | 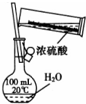 稀释浓硫酸 | D. | 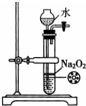 制备少量O2 |
11. Hg是水体污染的重金属元素之一.水溶液中二价汞的主要存在形态与C1-、OH-的浓度关系如图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-lgc(Cl-)].下列说法不正确的是( )
Hg是水体污染的重金属元素之一.水溶液中二价汞的主要存在形态与C1-、OH-的浓度关系如图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-lgc(Cl-)].下列说法不正确的是( )
 Hg是水体污染的重金属元素之一.水溶液中二价汞的主要存在形态与C1-、OH-的浓度关系如图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-lgc(Cl-)].下列说法不正确的是( )
Hg是水体污染的重金属元素之一.水溶液中二价汞的主要存在形态与C1-、OH-的浓度关系如图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-lgc(Cl-)].下列说法不正确的是( )| A. | 可用如下方法除去污水中的Hg2+:FeS(s)+Hg2+(aq)=HgS(s)+Fe2+(aq) | |
| B. | 当溶液pCl保持在1,pH在6~8时,汞元素主要以HgCl42-形式存在 | |
| C. | HgCl2是一种强电解质,其电离方程式是:HgCl2=HgCl++Cl- | |
| D. | 当溶液pH保持在5,pCl由2改变至6时.可使HgCl2转化为Hg(OH)2 |
1.短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与其他三种元素原子的内层电子数相同.X、Y均能与Z分别形成原子个数比为1:1、1:2的气态化合物.根据以上叙述,下列说法不正确的是( )
| A. | 上述气态化合物分子中所有原子最外层电子数均为8 | |
| B. | X、Y、Z都可与W形成既有极性共价键又有非极性共价键的化合物 | |
| C. | 化合物W4XY2Z可能是离子化合物,也可能是共价化合物 | |
| D. | 沸点:W2Z>YW3>XW4 |
12.既能用浓硫酸,又能用碱石灰干燥的气体是( )
| A. | Cl2 | B. | SO2 | C. | N2 | D. | NH3 |
13.向一定量的Cu、Fe2O3、的混合物中加入300mL 1mol/L的盐酸,恰好使混合物完全溶解,所得溶液中不含Fe3+原混合物中Cu的质量为( )
| A. | 9.6g | B. | 6.4g | C. | 3.2g | D. | 1.6g |


 ;I的分子式是C8H6O3.
;I的分子式是C8H6O3.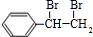 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$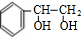 +2NaBr;反应类型属于水解反应.
+2NaBr;反应类型属于水解反应.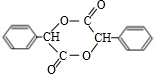 .
. 或
或 .
.