题目内容
3.下列叙述正确的是( )| A. | 在某反应中,当反应物具有的总能量大于生成物具有的总能量时,该反应吸热 | |
| B. | 同温同压下,4Al(s)+3O2(g)═2Al2O3(s)在常温和点燃条件下的△H不同 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)═H2O(l);△H=-53.7KJ/mol,若将含0.5molH2SO4的浓溶液与含1molNaOH的溶液混合,放出的热量大于53.7kJ | |
| D. | 需要加热的化学反应一定是吸热反应 |
分析 A.当反应物具有的总能量大于生成物具有的总能量时,反应放热;
B.在相同条件下,反应热只有物质的始末状态有关;
C.浓硫酸溶于水放热;
D、不能根据反应条件来判断反应吸放热.
解答 解:A.从能量守恒的角度分析,当反应物具有的总能量大于生成物具有的总能量时,反应放热,故A错误;
B.在相同条件下,反应热只有物质的始末状态有关,与反应条件无关,故B错误;
C.浓硫酸溶于水放热,放出的热量大于53.7KJ,故C正确;
D、反应吸放热与反应条件无关,即需要加热的反应不一定是吸热反应,如煤炭的燃烧,故D错误.
故选C.
点评 本题综合考查反应热与焓变知识,侧重于反应热、中和热、稳定性的判断,注意相关基础知识的学习,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.向一定量的Cu、Fe2O3、的混合物中加入300mL 1mol/L的盐酸,恰好使混合物完全溶解,所得溶液中不含Fe3+原混合物中Cu的质量为( )
| A. | 9.6g | B. | 6.4g | C. | 3.2g | D. | 1.6g |
11.下列叙述正确的是( )
| A. | 常温下1L0.1mol/LNH4Cl溶液与2L0.05mol/LNH4Cl溶液中c(NH4+)相等 | |
| B. | pH=5的CH3COOH溶液和pH=5的NH4NO3溶液中,c(H+)相等 | |
| C. | pH=6的CH3COOH和CH3COONa混合液中:c(Na+)+c(OH-)-c(CH3COO-)=10-6mol/L | |
| D. | pH=9的NaHA溶液中:c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-)>c(H+) |
8.下列推断符合实际的是( )
| A. | 第n周期的最后一种金属元素处在第n-1族(1<n<7,n为正整数) | |
| B. | m=1和m=7(m为最外层电子数)的元素单质能形成的化合物都是离子化合物 | |
| C. | m-n=5(m为最外层电子数,n为电子层数)的主族元素存在最强的对应含氧酸 | |
| D. | 第n周期有n种主族金属元素(1<n<7,n为正整数) |
12.短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示.下列说法不正确的是( )
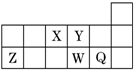

| A. | 元素的非金属性:Y>W | |
| B. | 阴离子的还原性:W2->Q- | |
| C. | 离子半径:Y2->Z3+ | |
| D. | Q、W、Y对应的氢化物的沸点逐渐降低 |
13.下列化学用语表示正确的是( )
| A. | 氧的原子结构示意图: | B. | 甲烷的比例模型: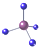 | ||
| C. | 硫化钾的电子式: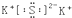 | D. | CO2的结构式:O-C-O |
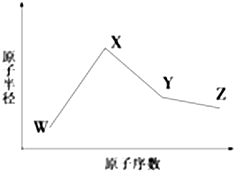 W、X、Y、Z、M、N是六种常见的短周期元素,其中W、X、Y、Z原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.M的原子序数比Y小1,N元素最高化合价是最低化合价绝对值的3倍.
W、X、Y、Z、M、N是六种常见的短周期元素,其中W、X、Y、Z原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期主族元素中最强.M的原子序数比Y小1,N元素最高化合价是最低化合价绝对值的3倍.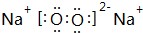 ,
, 完成下列空白.
完成下列空白. ;
; +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$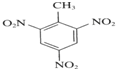 +3H2O.
+3H2O.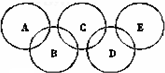 如图所示五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素;五种化合物由四种短周期元素形成,每种化合物仅含有两种元素.A是工业制取硝酸的主要原料之一;B、E分子中所含电子数都为18,B不稳定,具有较强的氧化性,E是由六个原子构成的分子,可作火箭燃料;C是工业制光导纤维的主要原料;D中所含的两种元素的原子个数之比为3:4.根据以上信息回答下列问题:
如图所示五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素;五种化合物由四种短周期元素形成,每种化合物仅含有两种元素.A是工业制取硝酸的主要原料之一;B、E分子中所含电子数都为18,B不稳定,具有较强的氧化性,E是由六个原子构成的分子,可作火箭燃料;C是工业制光导纤维的主要原料;D中所含的两种元素的原子个数之比为3:4.根据以上信息回答下列问题: