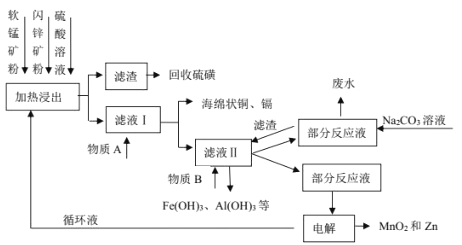
题目内容
【题目】I.氢氧燃料电池是符合绿色化学理念的新型发电装置,如图1为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
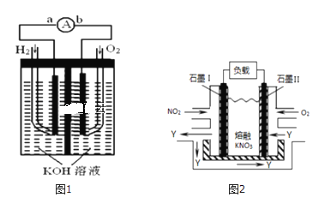
(1)负极反应式为______.
(2)电极表面镀铂粉的原因为______.
II.分析下列电解过程:
(1)写出惰性电极电解CuSO4溶液的总反应的离子方程式:______;
(2)写出惰性电极电解NaCl溶液的阳极反应式______;电解一段时间后加______(填物质名称)恢复电解前状况.
III.NO2、O2和熔融KNO3可制作燃料电池,其原理如图2
(1)请写出负极的电极方程式:______.
(2)相同条件下,放电过程中消耗的NO2和O2的体积比为______.
【答案】H2+2OH--2e-=2H2O 增大电极单位面积吸附H2、O2的分子数,加速电极反应速率 2Cu2++2H2O![]() 2Cu+O2↑+4H+ 2Cl—2e-=Cl2↑ 氯化氢 NO2+NO3—-e-=N2O5 4:1
2Cu+O2↑+4H+ 2Cl—2e-=Cl2↑ 氯化氢 NO2+NO3—-e-=N2O5 4:1
【解析】
(Ⅰ)(1)燃料电池中,通入燃料的电极是负极;
(2)根据“电池电极表面镀一层细小的铂粉,吸附气体的 能力强,性质稳定”来回答;
(Ⅱ)(1)惰性电极电解CuSO4溶液,根据电极反应和放电顺序写出总反应方程式;
(2)惰性电极电解NaCl溶液生成氢氧化钠、氯气和氢气,若想恢复电解前状况,电解过程中出什么加什么;
(Ⅲ)根据通入气体判断两极,电极反应式和电池反应式,根据电池总反应4NO2+O2=2N2O5计算。
(Ⅰ) (1)燃料电池中,通入燃料氢气的电极是负极,发生电极反应:![]() ,故答案为:
,故答案为:![]() ;
;
(2)根据题目信息:“电池电极表面镀一层细小的铂粉,吸附气体的能力强,性质稳定”,可知电极表面镀铂粉的原因为增大气体的吸附面积,保证气体充分参与电极反应,
故答案为:增大电极单位面积吸附H2、O2的分子数,加速电极反应速率;
(Ⅱ)(1)惰性电极电解CuSO4溶液,阳极是氢氧根离子失电子发生氧化反应,电极反应为:![]() ,阴极电极反应为:
,阴极电极反应为:![]() ,总反应方程式为:
,总反应方程式为:![]() ,
,
故答案为:![]() ;
;
(2)惰性电极电解NaCl溶液生成氢氧化钠、氯气和氢气,反应的离子方程式为:![]() ,阳极反应式:
,阳极反应式:![]() ,若想恢复电解前状况,电解过程放出氢气和氯气,所以加入氯化氢恢复溶液浓度,
,若想恢复电解前状况,电解过程放出氢气和氯气,所以加入氯化氢恢复溶液浓度,
故答案为:![]() ;氯化氢;
;氯化氢;
(Ⅲ)(1)据题意,通O2一极为正极,电极反应式为![]() ;通NO2一极为负极,电极反应为:
;通NO2一极为负极,电极反应为:![]() ,
,
故答案为:![]() ;
;
(2)通O2一极为正极,电极反应式为![]() ;通NO2一极为负极,电极反应为:
;通NO2一极为负极,电极反应为:![]() ,得到电池总反应
,得到电池总反应![]() ,相同条件下,放电过程中消耗的NO2和O2的体积比为4:1,
,相同条件下,放电过程中消耗的NO2和O2的体积比为4:1,
故答案为:4:1。

【题目】某实验小组用硫酸酸化的高锰酸钾溶液与草酸溶液反应测定单位时间内生成CO2的量来探究影响反应速率的因素。设计实验方案如表:
实验序号 | A溶液 | B溶液 |
① | 20mL0.1mol·L-1H2C2O4溶液 | 30mL0.02mol·L-1酸性KMnO4溶液 |
② | 20mL0.2mol·L-1H2C2O4溶液 | 30mL0.02mol·L-1酸性KMnO4溶液 |
(1)图1装置中盛放A溶液的仪器名称是_____,检验如图1装置气密性的方法为_____。

(2)硫酸酸化的高锰酸钾溶液与草酸溶液反应的化学反应方程式为_____。
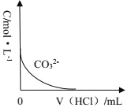
(3)此实验探究的是_____因素对化学反应速率的影响,若实验②在40s末收集了22.4mLCO2(标准状况下),则在40s内,v(MnO4-)=_____(忽略溶液混合前后体积的变化)。
(4)小组同学将图1的气体收集装置改为图2,实验完毕冷却后,读数时发现量气管液面高于干燥管液面,为得到准确数据,采取的操作是:____。
(5)除了通过测定单位时间内生成CO2的体积来比较反应速率,本实验还可以通过测定____来比较化学反应速率。
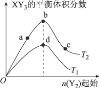
(6)同学们在实验中发现反应速率总是如图3所示,探究t1~t2时间内速率变快的主要原因可能是:____。
A.该反应放热 B.生成的Mn2+起催化作用 C.K2SO4浓度增大